| é═éČé▀é╔
ü@Äē¢bægÉDé╠Æåé╠Äē¢bæOŗņŹū¢EpreadipocytesüiīīŖŪŖįÄ┐Źū¢Evascular
stromal cellséŲéÓī─é╬éĻéĮüjé╠æČŹ▌é═ī├éŁé®éńÆméńéĻé─éóéĮé¬üAé▒é╠Äē¢bæOŗņŹū¢Eé╔ŖįŚtīnéé═éČé▀éŲéĘéķæĮĢ¬ē╗ö\é¬éĀéķé▒éŲé¬ŗ▀öNÄwōEé│éĻ[1-2]üAÉVéĮé╔adipose-derived
stromal (stem) cells (ł╚ē║ASCs)éŲéÓÅ╠é│éĻéķéµéżé╔é╚é┴éĮüBæSÉóŖEé┼¢łöN100¢£īÅéÆ┤é”éķéŲīŠéĒéĻéķÄē¢bŗzł°Åpé╔é©éóé─öpŖ³é│éĻéķŗzł°Äē¢bé═Ź£Éæé╔æŃéĒéķŹ─Éȳь├é╠Źū¢Eī╣éŲéĄé─ÆŹ¢┌éŚüéčéķéµéżé╔é╚éĶüAé╗é╠Ź╠ĵé╠ÆSéóÄĶé┼éĀéķī`ɼŖOē╚łŃé╔éŲé┴é─éÓé╗é╠łėŗ`é═ö±ÅĒé╔æÕé½éóüB
ü@é▒éĻé▄é┼é╔æĮéŁé╠īżŗåé╔éµé┴é─üAāqāgASCüihASCüjé¬Äē¢büAŹ£üAōŅŹ£üAŹ£ŖiŗžüAÉSŗžüAīīŖŪüAŖ╠æ¤é╚éŪé╠Ģ¹ī³éųĢ¬ē╗éĘéķé▒éŲé¬Ä”é│éĻé─é½éĮ[3-11]üBéĒéĻéĒéĻéÓŚšÅ░ē׌pé╔ī³é»é─üAÄ└Ź█é╠Źū¢Eī╣éŲé╚éķÄē¢bŗzł°ŗzł°Ģ©(liposuction
aspirates)é╔ō┴é╔ÆŹ¢┌éĄüAŗzł°Äē¢béɞţÄē¢béŲöõŖréĄüAé▄éĮŗzł°Ģ©é╠Æåé╠üAĢéŚVéĘéķŗzł°Äē¢bĢöĢ¬é©éµéčē║æwé╠ŗzł°öpētĢöĢ¬é®éńŹ╠ĵé│éĻéķŹū¢EīQé╔é┬éóé─é╗éĻé╝éĻĢ¬É═üAöõŖrī¤ōóéĄéĮ[12]üBé▄éĮüAé▒é╠Źū¢EīQéÄē¢bł┌ÉAé╔ĢŌÅĢōIé╔ŚśŚpéĘéķægÉDæØæÕÅpéŹlł─éĄüAASCé¬ē╩éĮéĘŗ@ö\é╔é┬éóé─ī¤ōóéĄéĮüB
éPüD ŗzł°Äē¢b(aspirated fat; lipoaspirates)é╠ō┴Æź
ü@Äē¢bŗzł°é╔éµé┴é─ōŠéńéĻéķŗzł°Äē¢bé═üAīa2-3mmé╠ŗÓæ«āJājāģü[āīéÆ╩éĄé─ōŠéńéĻéķöjŹėé│éĻéĮÄē¢bægÉDé┼éĀéķüBŗ@ŖBōIé╚öjŹėé│éĻé─éóéķéŠé»é┼é╚éŁüAāgāDāüāZāōāgŗzł°¢@é╔éµéĶæÕīīŖŪéŌÉ_īoé╚éŪéē┬ŗyōIé╔ÅØé┬é»é╚éóéµéżé╚özŚČééÓé┴é─Ź╠ĵé│éĻéĮÄē¢bægÉDé┼éĀéķüBéĘé╚éĒé┐üAŗzł°Äē¢bé═æÕé½é╚īīŖŪéŌÉ_īoé╔¢RéĄéŁüAé╗é╠ijł═é╠īŗŹćægÉDéÓ¢RéĄéóüBöjŹėé│éĻé─éóéķé¬éõé”é╔üAægÉDé╠żĢąé¬ĢéŚVéĄé─éóéķéŲéŲéÓé╔üAŗ@ŖBōIé╔öjē¾é│éĻéĮɼÅnÄē¢bŹū¢EéÓæĮéŁŖ▄é▄éĻé─éóéķüBé▒éĻéńé╠ō┴Æźé═üAī§ī░üAōdī░é┼üAŗzł°Äē¢béŲɞţÄē¢bægÉD(excised
fat)éŲéöõŖrī¤ōóéĘéķé▒éŲé╔éµé┴é─éÓŖmöFéĘéķé▒éŲé¬é┼é½éķüiÉ}éPüjüB
ü@é│éńé╔é╗éĻé╝éĻé®éńASCéÆPŚŻéĘéķéŲüAŗzł°Äē¢bé®éńé═É│ÅĒÄē¢bægÉDéŲöõéūéķéŲŚLłėé╔ÅŁé╚éóÉöüiĢĮŗŽ48%üjé╠ASCéĄé®Ź╠ĵé│éĻé╚éóé▒éŲé¬éĒé®é┴éĮüBéĘé╚éĒé┐üAŗzł°Äē¢bægÉDé═É│ÅĒÄē¢bægÉDéŲöõéūéķéŲüAŖ▓Źū¢EüiæOŗņŹū¢Eüjé¬æŖæ╬ōIé╔īć¢RéĄé─éóéķüBŗzł°Äē¢bægÉDé╔ASCé¬ÅŁé╚éóé▒éŲé═üAÅŃŗLé╠æÕīīŖŪ鬢RéĄéóé▒éŲé╔ē┴é”üAŗ@ŖBōIé╚öjŹėéŌōÓł÷ɽé╠ŹyæföĮē×é╚éŪé╔éµéĶüAŗzł°ÄĶÅpÆåéŌŗzł°ĢrōÓé┼é╠Ģ█æČÆåé╔ASCé¬öpētÆåé╔ŚVŚŻé│éĻé─éóéķē┬ö\ɽéÓéĀéķüBASCé¬ŗzł°Äē¢bé®éńŚVŚŻé│éĻéķé▒éŲé═üAŗzł°öpēté®éńéÓASCé¬ÆPŚŻé│éĻéķüiīŃÅqüjé▒éŲé®éńéÓ¢Šéńé®é┼éĀéķüB
éQüD Äē¢bŗzł°ŗzł°Ģ©(liposuction aspirates)
Äē¢bŗzł°é┼Ź╠ĵé│éĻéķŗzł°Ģ©é═üAŗzł°Ģré╠Æåé┼ō±æwé╔Ģ¬ŚŻé│éĻéķüBÅŃæwé═üAĢéŚVéĘéķŗzł°Äē¢bé®éńɼéĶüAē║æwé═ŗzł°öpēté®éńé╚éķüBé▒é╠ŗzł°öpēté═üAāgāDāüāZāōāgētüiÉČŚØÉHē¢ÉģüAāŖāhāJāCāōüAāAāhāīāiāŖāōé╚éŪüjüA¢¢ÅĮīīüAægÉDöjŹėżĢąé╚éŪé®éńé╚éķüBé▒é▒é┼é═üAÅŃæwüiŗzł°Äē¢büjüAē║æwüiŗzł°öpētüjé®éńŹ╠ĵé│éĻéĮŹū¢EɼĢ¬(Ź╠ĵé│éĻéĮÉVæNé╚éÓé╠éstromal
vascular fractions; SVFéŲī─éį)éüAé╗éĻé╝éĻprocessed lipoaspirate
(PLA) cellsüAliposcution aspirate (LAF) cellséŲ ī─éįüB
éRüD PLAéŲLAF
ü@Ś╝Äęé╠Źū¢EéÉVæNé╚žæįüAö|Ś{éĄéĮžæįé┼öõŖrī¤ōóéĄéĮüBéŪé┐éńéÓÄē¢bŚRŚłŹū¢EéŲīīētŚRŚłŹū¢EéŖ▄é±é┼éóéķé¬üAöpētŚRŚłé╠LAFé╠Ģ¹é¬ł│ō|ōIé╔æĮéŁé╠īīētŚRŚłŹū¢EéŖ▄é±é┼é©éĶüAÄē¢bŗzł°ÅpÆåé╠ÅoīīŚ╩é╔ēeŗ┐éľé»éķüBŹ╠ĵéĄéĮÉVæNé╚žæįé╔é©éóé─üAPLAŹū¢EéŲLAFŹū¢Eé═é┘é┌ō»Éöé┼éĀéķé¬üAÉ┌Æģö|Ś{éĘéķéŲPLAŹū¢Eé═ŚLłėé╔Éöé¬æĮéóüiĢW¢{é╔éµéĶ1.5é®éń10ö{üjüBPLAŹū¢Eé═LAFŹū¢Eé╔öõéūé─üAÄē¢bŚRŚłŹū¢EüiCD45ü|üjéæĮéŁŖ▄é▌üAīīētŚRŚłŹū¢EüiCD45+üjé╠ŖäŹćé¬Å¼é│éóüBLAFŹū¢Eé═ÉVæNé╚žæįé┼éÓæŖō¢Éöé╠CD34ü{CD45-Źū¢EüiÄē¢bŚRŚłŹū¢EüGæÕö╝é═ASCüjéŖ▄é±é┼é©éĶüAé│éńé╔ö|Ś{éĘéķéŲüAö|Ś{PLAŹū¢EéŲé╗é╠ī`æįüAö|Ś{ö{ē╗Ä×ŖįüAæĮĢ¬ē╗ö\üiÄē¢büAŹ£üAōŅŹ£üjüAŹū¢EĢ\¢╩ŹRī┤öŁī╗鬏ōÄŚéĄé─é©éĶüAŗzł°öpēté╔éÓæŖō¢Éöé╠ASCé¬Ŗ▄é▄éĻé─éóéķé▒éŲ鬢Šéńé®éŲé╚é┴éĮ[12]üB
éSüD SVFé╠Źū¢Eægɼ
ü@ŗzł°Äē¢büAŗzł°öpēté╗éĻé╝éĻé®éńŹ╠ĵéĄéĮSVFüiüüÉVæNPLAŹū¢EüAÉVæNLAFŹū¢EüjÆåé╠ÉįīīŗģéŚnēāoābātā@ü[é┼ÅłŚØéĄéĮīŃé╔ā}āŗā`āJāēü[FACSéŚpéóé─üAĢ\¢╩ŹRī┤é╠łßéóé╔éµéĶSVFÆåé╠Źū¢Eé╠ægɼéĢ¬É═éĄéĮüBPLAüALAFé╔é©éóé─üAÄē¢bŚRŚłŹū¢Eé¬é╗éĻé╝éĻ30ü`50üōüA3ü`15%éÉĶé▀üAÄcéĶéīīētŚRŚłŹū¢Eé¬ÉĶé▀é─éóéĮüBÄē¢bŚRŚłŹū¢Eé╠æÕö╝é═CD34ü{Źū¢Eé┼üAé╗é╠æĮéŁé═ASCüiCD31-CD34+CD45-CD90+CD105-CD146-üjé┼éĀéĶüAĢöĢ¬ōIé╔īīŖŪōÓöńüiæOŗņüjŹū¢EüiCD31+CD34+CD45-CD90+CD105lowCD146+üjéŖ▄é±é┼éóéĮ12üBé┘é®é╔īīŖŪijŹū¢EéŌɳł█ēĶŹū¢Eé╠ō┴ÆźéÄ”éĘŹū¢Eé¬Ŗ▄é▄éĻé─éóéķé▒éŲé¬öFé▀éńéĻéĮüBSVFé╠Ź\ɼŹū¢EéĢ\éPé╔é▄éŲé▀éĮüB
éTüD ö|Ś{ASCé╠Źū¢EĢ\¢╩ŹRī┤öŁī╗é╠ĢŽē╗
ü@ASCéÉ┌Æģö|Ś{éĘéķéŲÉVæNÄ×é╔é═öŁī╗é¬é╚é®é┴éĮCD105üiendoglin; ŖįŚtīnŖ▓Źū¢Eé╠ā}ü[āJü[é╠éPé┬üjé╠öŁī╗é¬ÉVéĮé╔ī®éńéĻéķéµéżé╔é╚éķ[12]üBö|Ś{éæ▒é»éķéŲüACD34é╠öŁī╗é═ÅÖüXé╔īĖÅŁéĄüADMEMé┼ö|Ś{éĄé─éóéķéŲ¢±éQÅTŖįé┼CD34é╠öŁī╗é¬é╚éŁé╚éķé¬üAö|Ś{Ģ¹¢@é╔éµé┴é─é═CD34é╠öŁī╗éÆĘŖ·ōIé╔ł█ÄØéĘéķé▒éŲéÓē┬ö\é┼éĀéķüBé▄éĮüAASCé═ö|Ś{Ģ¹¢@é╔éµéĶé╗é╠Ģ\ī╗ī`éæÕé½éŁĢŽé”éķé▒éŲéÓéĒé®é┴é─é©éĶüAFlk-1é╠ŗŁéóöŁī╗éŚUō▒éĘéķé▒éŲéÓē┬ö\é┼éĀéķ13üBö|Ś{PLAŹū¢EéŲö|Ś{LAFŹū¢Eé╠ÄÕé╚Źū¢EĢ\¢╩ŹRī┤é╠öŁī╗üiö|Ś{éPÅTüAéSÅTüAéPéOÅTüjéĢ\éQé╔Ä”éĘüB
éUüD ŖįŚtīnæOŗņŹū¢Eé╔é©é»éķASCé╠ō┴Æź
ü@ASCé═üAöńĢåɳł█ēĶŹū¢Eéé═éČé▀üAŹ£ÉæŚRŚłŖįŚtīnŖ▓Źū¢EüiBM-MSCüjüAõ`æčŚRŚłŖ▓Źū¢Eé╚éŪŖįŚtīné╠ægÉDæOŗņŹū¢EéŲī`æįōIé╔é═Ś▐ÄŚéĄé─é©éĶüAé▄éĮéóéĖéĻéÓÉ┌Æģö|Ś{é╔é─Śełšé╔æØÉBé│é╣éķé▒éŲé¬é┼é½éķüBŹū¢EĢ\¢╩ŹRī┤é╠öŁī╗é┼öõŖréĘéķéŲüAASCé═BM-MSCéŲö±ÅĒé╔ÄŚé─éóéķé¬üACD34é╠öŁī╗é¬ō┴é╔ÉVæNÄ×éŌö|Ś{Ŗ·Ŗįé¬ÆZéóÄ×Ŗ·é╔é═ö±ÅĒé╔Źééóō┴ÆźéÄØé┬üBö|Ś{¢@é╔éµé┴é─é═20ē±īpæŃéĄé─éÓ20%ŗ▀éóŹū¢Eé┼CD34öŁī╗éł█ÄØéĘéķé▒éŲéÓē┬ö\é┼éĀéķ[12]üBö|Ś{ɳł█ēĶŹū¢Eé═CD34é╠öŁī╗鬢RéĄéóéŠé»é┼é╚éŁüACD105éŌCD146é╠öŁī╗é¬é┘éŲé±éŪé╚éóō_é╔é©éóé─ö|Ś{ASCéŲ¢ŠŖmé╔ł┘é╚é┴é─éóéķüiÉ}éQüjüB
éVüD ŗzł°Äē¢bł┌ÉAéASCüiSVFüjé┼ĢŌÅĢéĘéķü|Cell-Assisted
Lipotrasfer (CAL)
ü@æOÅqé╠é▓éŲéŁüAŗzł°Äē¢bé═É│ÅĒÄē¢bægÉDé╔öõéūé─Ŗ▄ŚLASCé¬ÅŁé╚éóüBé▒é╠é▒éŲé═ŗzł°Äē¢bægÉDé╠ÆŹō³ł┌ÉAīŃé╔ł┌ÉAé│éĻéĮÄē¢bægÉDé╠ÉČÆģéŌÆĘŖ·ōIé╚ł█ÄØé╔ĢsŚśé╚ÅīÅéŚ^é”é─éóéķē┬ö\ɽé¬éĀéķüBÄē¢bÆŹō³éŲéóéżÄĪŚ├¢@é═üAīīŹsé¬é╚éóŚVŚŻĢĪŹćægÉDł┌ÉAé┼éĀéĶüAīīŹsé¬Ģsł└ÆĶé┼éĀéķé▒éŲé®éńüAł┌ÉAægÉDé╠ĢöĢ¬ē¾ÄĆé╔éµéķĢsŖmÄ└ɽéŌĢsł└ÆĶé╚ægÉDé╠ÄØæ▒ɽüAŗUöXßvéŌÉ╬ŖDē╗é╠ī`ɼé╚éŪ鬢ŌæĶéŲé│éĻéķüBéĄé®éĄüAł┌ÉAÄĪŚ├é╔é©éóé─ߏŹŁéÄcé│é╚éóéŲéóéżö³ŚeÄĪŚ├é╠ŖŽō_é®éńé═ÉŌæ╬ōIÆĘÅŖéÄØé┴é─é©éĶüAé╗é╠īćō_é¬ēÅ┴é│éĻéķé▒éŲé╠łėŗ`é═ö±ÅĒé╔æÕé½éóüB
ł┌ÉAŹ▐Ś┐é╠ASCīć¢RžæįéĢŌōUéĘéķ¢┌ōIé┼üAŗzł°Äē¢bé╔ASCéē┴é”É┌Æģé│é╣é─üAASC-richÄē¢bé╠žæįé┼ł┌ÉAéĘéķĢ¹¢@éüACell-Assisted
Lipotrasfer (CAL)éŲ¢╝é├é»üiÉ}éRüjüAÄ└ī▒ōIé╚ī¤ōóéŹsé┴éĮüB
éWüD CALé╠ō«Ģ©Ä└ī▒é╔éµéķŚLī°É½
ü@CALé╠ŚLī°É½éī¤ōóéĘéķ¢┌ōIé┼üAāqāgŗzł°Äē¢bé╔éSö{Ś╩é╠ŗzł°Äē¢bé®éńōŠéńéĻéķASCéē┴é”é─SCIDā}āEāXöńē║éųé╠ł┌ÉAÄ└ī▒éŹsé┴éĮüBł┌ÉAÄē¢bé═ASCéē┴é”éĮéŲé½é╔ŚLłėé╔æÕé½éŁüAō┴é╔ijĢėĢöé╔é©é»éķÉVÉČīīŖŪé╠łßéóé¬öFé▀éńéĻüAÆåÉSĢöé╠ē¾ÄĆö═ł═é¬Å¼é│é®é┴éĮüBDiIé┼āēāxāŗéĄéĮASCé═ł┌ÉAÄē¢bé╠īŗŹćægÉDōÓéŌɼÅnÄē¢bŹū¢Eé╠Ŗįé╔ŗ▓é▄éĻéķéµéżé╔æČŹ▌éĄé─éóéĮüBł┌ÉAÄē¢bōÓé╔é═von
Willbrand factorŹRæ╠é┼¢ŲēuɧÉFé│éĻéķASCé¬æČŹ▌éĄüAīīŖŪōÓöńŹū¢Eé╔Ģ¬ē╗éĄé─éóéķé▒éŲé¬Ä”Ź┤é│éĻéĮüBō»Ślé╔üAGFPāēābāgüiSDāēābāgŚRŚłüjéÄgé┴é─üAGFPāēābāgŚRŚłASCéSDāēābāgé╠öjŹėÄē¢béŲŹ¼ŹćéĄé─ł┌ÉAéĄéĮÄ└ī▒é┼üAGFPŚzɽé╠īīŖŪōÓöńé¬öFé▀éńéĻüAéŌé═éĶīīŖŪōÓöńŹū¢Eéųé╠Ģ¬ē╗é¬Ä”Ź┤é│éĻéĮüiÉ}éSüjüB
éXüD CALé╔é©é»éķASCé╠¢Ŗä
ü@CALé╔é©é»éķASCé╠¢Ŗäé═éSé┬Źlé”éńéĻéķüBéPé┬é═üAASCé¬É¼ÅnÄē¢bŹū¢Eé╔Ģ¬ē╗éĄüAł┌ÉAÄē¢bé╠Äē¢bŹū¢Eé╠łĻĢöéŹ\ÆzéĘéķé▒éŲüBāēāxāŗé│éĻéĮɼÅnÄē¢bŹū¢Eé═Ä└ī▒ōIé╔é═öFé▀éńéĻé╚é®é┴éĮé¬üAÄ└Ź█é╔é═ɼÅnÄē¢bŹū¢Eé═æÕö╝é¬Æ~ÉŽé│éĻéĮÆåɽÄē¢bé¬ÉĶé▀é─é©éĶŹū¢EÄ┐é╠āēāxāŖāōāOé═ÄŖō’é┼éĀéķé▒éŲé¬ÆméńéĻé─éóéķüBASCé═Å]Śłé®éńÄē¢bæOŗņŹū¢EéŲī─Å╠é│éĻüAɼÅnÄē¢bŹū¢EéŲŗżö|Ś{éĘéķéŲÄē¢bŹū¢Eéųé╠Ģ¬ē╗é¬Ähīāé│éĻéķé▒éŲé═ÆméńéĻé─é©éĶ[14]üAł┌ÉAīŃŗ}ɽŖ·é╠ēŖÅŪéŌÉ┌ÉGéĄé─éóéķł┌ÉAÄē¢bé╠Ähīāé╔éµéĶÄē¢bŹū¢Eéųé╠Ģ¬ē╗é═Å\Ģ¬é╔Źlé”éńéĻéķüBéQé┬é▀é═üAASCé¬īīŖŪōÓöńŹū¢EéųĢ¬ē╗éĄüAŗ}ɽŖ·é╠īīŖŪÉVÉČé╔Ŗ±Ś^éĘéķé▒éŲüBASCé¬īīŖŪōÓöńŹū¢EéųĢ¬ē╗éĘéķé▒éŲé═Ź┼ŗ▀é╠ĢĪÉöé╠īżŗå[10,11,13]é╔é©éóé─éÓüAé▄éĮéĒéĻéĒéĻé╠īżŗåé╔é©éóé─éÓŖmöFé│éĻéĮüBéRé┬é▀é═üA¢óĢ¬ē╗é╚ASCé╠žæįé┼ł┌ÉAÄē¢bé╔æČŹ▌éĄüAæOŗņŹū¢EéŲéĄé─ŚłéĮéķÄē¢bŹū¢Eé╠ā^ü[āōāIü[āoü[é╔ö§é”éķüBéĒéĻéĒéĻé╠īżŗåé╔éµéĶüA¢{Śłé╠ASCéŲō»éČéµéżé╔īŗŹćægÉDōÓéŌÄē¢bŹū¢EŖįé╔æČŹ▌éĘéķé▒éŲé¬ŖmöFé│éĻéĮüBéSé┬é▀é═üAł┌ÉAÆ╝īŃé╠ÆßÄ_æfüiæjīīüjžæįé╔éµéĶīīŖŪÉVÉČŚUō▒ł÷ÄqéĢ·ÅoéĘéķé▒éŲé╔éµéĶüAīīŖŪÉVÉČéŚUō▒éĄüAł┌ÉAægÉDé╠ÉČÆģé╔Ŗ±Ś^éĘéķé▒éŲüBæ╝é╠īżŗåé╔éµéĶüAASCé═ÆßÄ_æfžæįé┼VEGFéŌHGFé╚éŪé╠īīŖŪÉVÉČŹņŚpéÄØé┬æØÉBł÷ÄqéĢ·ÅoéĘéķé▒éŲé¬ÆméńéĻé─éóéķ[15]üBé▒éżéóé┴éĮētɽł÷Äqé¬āpāēāNāēāCāōé┼ijł═é╠ægÉDé╔ŹņŚpéĄüAīīŖŪÉVÉČé¬æŻÉié│éĻéķé▒éŲ鬏lé”éńéĻéķüB
éPéOüD ASCé╠ŚšÅ░ē׌pé╔ī³é»é─
ü@Ä└Ź█é╠ŚšÅ░ē׌pé╔é©éóé─é═ł└æSɽé╠ŖŽō_é®éńüAē┬ö\é┼éĀéĻé╬Ä®ī╚ŚRŚłŹū¢Eé┼üAé®é┬ö|Ś{éĄé╚éóžæįüiminimal
manipulationüjé┼ŚśŚpéĘéķé▒éŲ鬢]é▄éĻéķüBĢ─ŹæFDAé═2004öN11īÄé╔āqāgægÉDźŹū¢EŚRŚłÉ╗Ģié╠É╗æóŖŅÅĆ[16]éɦÆĶéĄüAé▒é╠ŗKæźé®éńÅ£ŖOé│éĻéķægÉDéŌŹū¢Eé╠ŚßéŲéĄé─üAīīŹsŹ─īÜé│éĻéķł┌ÉAæ¤ŖĒüAminimal
manipulationé│éĻéĮŹ£ÉæægÉDüAæ╝ō«Ģ©ŚRŚłÉ╗ĢiüAæSīīé©éµéčīīētɼĢ¬üAĢ¬öÕéÓéĄéŁé═ÆŖÅoé│éĻéĮÉ╗ĢiüiĢĻō¹üAŹū¢EæØÉBł÷ÄqüAāRāēü[āQāōé╚éŪüFÉĖēté═é╠é╝éŁüjüAæ╠ŖOé┼é╠ÉfÆfŚpÉ╗ĢiüAæ╝ēŲŚRŚłÉSæ¤Ģ┘üEŹd¢īé╚éŪéŗōé░é─éóéķüBÉ╗Ģiéö╗ÆféĘéķŹ█é╠ŹĆ¢┌éŲéĄé─üAć@Ä®ī╚ŚRŚłé®æ╝ēŲŚRŚłé®üAćAÉČé½é─éóéķé®ÄĆé±é┼éóéķé®üAćBÉVæNé╚éÓé╠鮳ĻōxĢ█æČé│éĻéĮéÓé╠é®üAćC¢{Śłé╠ŗ@ö\üihomologous
useüjé®é╗éĻł╚ŖOé╠ŗ@ö\é®üAćCminimalé®minimalł╚ÅŃé╠manupilationé®(ÆŹéP)üAćDŗŪÅŖé┼ŹņŚpéĘéķéÓé╠é®æSÉgé╔ŹņŚpéĘéķéÓé╠é®üAćEæ╝é╠¢“ĢiéŌāfāoāCāXéŲægé▌ŹćéĒé╣é─ÄgŚpéĘéķéŪéżé®üAé╚éŪéŗōé░é─éóéķüBé▒éĻéńé╠éŪéĻé®éPé┬é╔Æ’ÉGéĘéķÅĻŹćé═üAŚšÅ░īżŗåéŹséżæOé╔üAFDAé╠Å│öFé¬ĢKŚvéŲé╚é┴éĮüB
500ccÆ÷ōxé╠ŗzł°Äē¢b鬏╠ĵé┼é½éķéµéżé┼éĀéĻé╬10é╠8ŵī┬ÆPł╩é╠ASC鬏╠ĵé┼é½éķé▒éŲé¬æzÆĶé│éĻüAÉVæNŹū¢Eé╠žæįé┼éÓÄ└Śpē╗ē┬ö\é╚Źū¢EÉöéŖmĢ█é┼é½éķéŲÄvéĒéĻéķüBÄ└Ź█é╔é═ł└æSɽé╠é▌é╚éńéĖüAŹū¢Eé╠Ä┐ōIé╚¢ŌæĶéÓæČŹ▌éĘéķüBASCé═ö|Ś{Ŗ·Ŗįé¬ÆĘéŁé╚éķéŲCD34ŚzɽŹū¢Eé¬īĖÅŁéĘéķüAHLA-A,B,Cé╠öŁī╗é¬īĖÅŁéĘéķ7é╚éŪüAé╗é╠ŗ@ö\ōIɽÄ┐üAĢ\ī╗ī^éÓĢŽē╗éĘéķé▒éŲé¬éĒé®é┴é─éóéķüBÅ]é┴é─üAŹ─Éȳь├é╠éŲéŁé╔ÅēŖ·é╠ÆiŖKé╔é©éóé─é═ÉVæNASCé╠žæįé┼é╠ŚšÅ░īżŗåé¬ÄÕŚ¼éŲé╚éķéŲÉäÄ@é│éĻéķüB
üiÆŹéPüjMinimal Manipulation: processing
that does not alter the biological or relevant functional
characteristics of cells or tissue.
Źū¢Eé╠ÉČĢ©ŖwōIźŗ@ö\ōIɽÄ┐éĢŽé”é╚éóö═ł═é╠ē┴ŹHŹsłūéÄwéĘüBŗ’æ╠ŚßéŲéĄé─üAægÉDé╠ÉžÆfźöjŹėźüAāAātāFāīü[āVāćāōüiēōÉSé╔éµéķīīŗģĢ¬ŚŻüjüAŹū¢Eé╠¢“ēté╚éŪé╔éµéķɶœüAŹū¢Eé╠ā\ü[āeāBāōāOüAŹū¢Eé╠ōĆīŗĢ█æČüAFicollé╚éŪé╠¢¦ōxī∙özēōÉSĢ¬ŚŻŚnēté╔éµéķŹū¢EĢ¬ŚŻüAāKāX¢┼ŗ█éŌĢ·Ä╦ɳ¢┼ŗ█üAé╚éŪé¬ŗōé░éńéĻé─éóéķüB
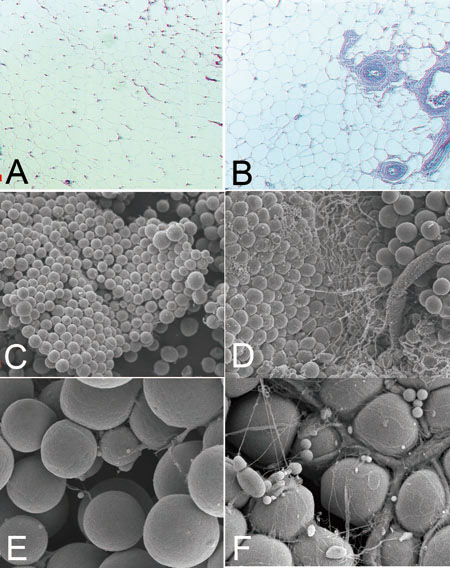
É}éPüDŗzł°Äē¢béŲɞţÄē¢bé╠ī`æįŖwōIöõŖr
üiéŲéÓé╔ō»łĻŖ│Äęé╠ĢĀĢöéµéĶŹ╠ĵéĄé─öõŖrüGAüACüAEé═ŗzł°Äē¢büABüADüAFé═ɞţÄē¢büj
AüABé═āpāēātāBāōĢW¢{é╠HEɧÉFüBCü|Fé═æ¢ŹĖōdī░ĢW¢{üiCüADé═ÄŃŖgæÕüAEüAFé═ŗŁŖgæÕüjüBŖŅ¢{Ź\æóé═éŪé┐éńéÓé┘é┌ō»Ślé┼éĀéķé¬üAŗzł°Äē¢bé╔é═æÕīīŖŪé¬ö±ÅĒé╔ÅŁé╚éóüBŗzł°Äē¢bé╠ÅĻŹćé═üAŹūéóāJājāģü[āīé╔éµéĶæÕīīŖŪéŌÉ_īoéÅØé┬é»é╚éóéµéżé╔Ź╠ĵé│éĻé─éóéķé▒éŲé╔éµéķéŲÄvéĒéĻéķüB
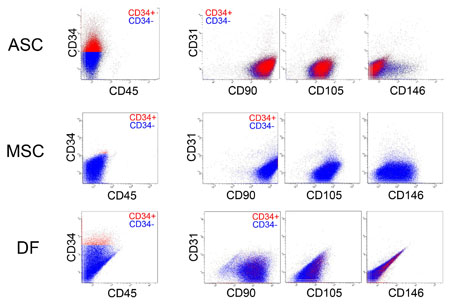
É}éQüDö|Ś{āqāgÄē¢bŚRŚłŖ▓Źū¢EüiASCüjüAö|Ś{āqāgŹ£ÉæŚRŚłŖįŚtīnŖ▓Źū¢EüiMSCüjüAö|Ś{āqāgÉ^öńŚRŚłÉ³ł█ēĶŹū¢EüiDFüjé╠ā}āŗā`āJāēü[FACSĢ¬É═
ī`æįōIé╔é═éóéĖéĻéÓɳł█ēĶŹū¢EŚlé┼éĀéĶŗ▀ÄŚéĄé─éóéķüBASCé═MSCéŲDFé╔öõéūé─üACD34é╠öŁī╗é¬ī░Æśé┼éĀéĶüAASCéŲMSCé═CD105üiŖįŚtīnŖ▓Źū¢Eé╠ā}ü[āJü[éŲéĄé─éÓÄgéĒéĻéķüjéŌCD146üiīīŖŪōÓöńŹū¢EüAijŹū¢Eé╠ā}ü[āJü[éŲéĄé─éÓÄgéĒéĻéķüjé╠öŁī╗é¬ī®éńéĻéķō_é¬DFéŲé═¢Šéńé®é╔ł┘é╚é┴é─éóéķüB
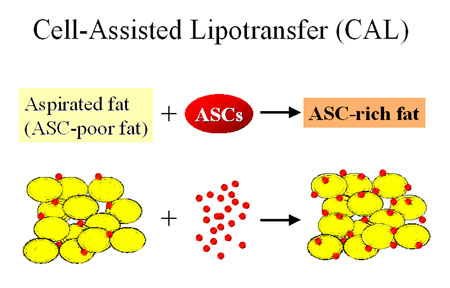
É}3üDCell-Assisted Lipotransfer (CAL)é╠ŖŅ¢{ŖTöO
ŗzł°Äē¢bé═ɞţÄē¢bé╔öõéĄüAŖ▄é▄éĻé─éóéķASCé╠Éöé¬ÅŁé╚éóüBASCé¬æŖæ╬ōIé╔īć¢RéĄé─éóéķÄē¢bé╔ASCéē┴é”é─É┌Æģé│é╣éķé▒éŲé╔éµéĶüAASC-richÄē¢béŲéĄé─ł┌ÉAŹ▐Ś┐éŲéĘéķüB
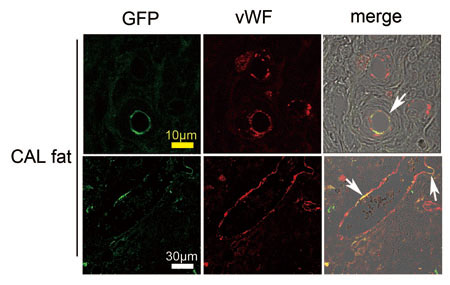
É}4üDGFPāēābāgŚRŚłASCéŲSDāēābāgŚRŚłöjŹėÄē¢béŲé╠Ź¼Źćł┌ÉAüiCAL fatüjüiSDāēābāgé╔ł┌ÉAé│éĻé─éóéķüj
CAL fatōÓé╔é═üAīīŖŪōÓöńé╠ā}ü[āJü[é┼éĀéķvon Willebrand factor(vWF)Śzɽé╠īīŖŪōÓöńé¬öFé▀éńéĻéķé¬üAé╗é╠łĻĢöé═GFPŚzɽé┼éĀéĶüAASCé¬īīŖŪōÓöńé╔Ģ¬ē╗éĄéĮé▒éŲéÄ”éĄé─éóéķüBīīŖŪĢŪæSæ╠é¬ASCŚRŚłé┼éĀéķīīŖŪéÓéĀéĻé╬üAĢŪé╠łĻĢöé╠ōÓöńé¬ASCŚRŚłé╠īīŖŪéÓī®éńéĻéķüB¢│ś_üAÅhÄÕŚRŚłé╠īīŖŪéÓæĮéŁöFé▀éńéĻéķüB
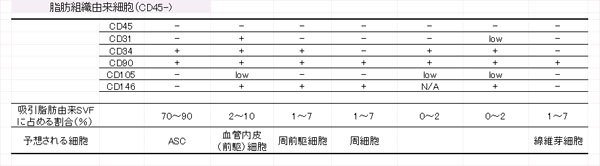
Ģ\éPüDŗzł°Äē¢bé®éńŹ╠ĵé│éĻéķÄē¢bŚRŚłŹū¢EīQé╠ægɼłĻŚŚ
ŗzł°Äē¢bé®éńŹ╠ĵé│éĻéķSVFé═üAÄē¢bŚRŚłŹū¢EüiCD45-üjéŲ¢¢ÅĮīīŚRŚłŹū¢EüiCD45+üjé®éńɼéķüBÄē¢bŚRŚłŹū¢Eé╠éżé┐üAɼÅnÄē¢bŹū¢Eé═ÅłŚØē▀Æ÷é┼öjē¾éÓéĄéŁé═öpŖ³é│éĻéķüBSVFé╠Æåé╔Ŗ▄é▄éĻéķÄē¢bŚRŚłŹū¢Eé═ĢsŗŽłĻé╚Źū¢EÅWÆcé┼éĀéķé¬üAé╗é╠æÕö╝é═ASCé┼éĀéķüB
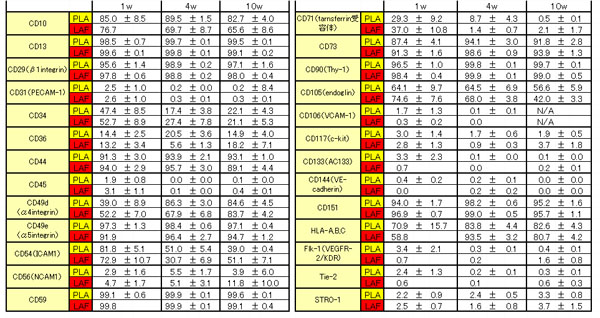
Ģ\éQüDö|Ś{PLAé©éµéčLAFŹū¢Eé╠Źū¢EĢ\¢╩ŹRī┤öŁī╗üiö|Ś{īŃ1ÅTüA4ÅTüAé©éµéč10ÅTüj
ÉVæNé╚žæįé┼é═LAFŹū¢Eé╔é═æĮéŁé╠¢¢ÅĮīīŚRŚłŹū¢Eé¬Ŗ▄é▄éĻé─é©éĶüAPLAŹū¢EéŲé═é╗é╠ægɼüAĢ\¢╩ŹRī┤öŁī╗é¬æÕé½éŁł┘é╚é┴é─éóéķé¬üAö|Ś{éĘéķéŲö±ÅĒé╔ÄŚÆ╩é┴é─éóéķüBö|Ś{¢@é╔éµé┴é─é═üA10ÅTŖįö|Ś{éĄé─éÓ10ü`20üōé╠Źū¢Eé┼CD34é╠öŁī╗é═ł█ÄØé│éĻé─éóéķüB
ü@
ÄQŹlĢČīŻ
1. Zuk PA, Zhu M, Ashjian P, et al.:
Human adipose tissue is a source of multipotent stem
cells. Mol Biol Cell 13: 4279-4295, 2002.
2. Zuk PA, Zhu M, Mizuno H, et al.: Multilineage cells
from human adipose tissue: implications for cell-based
therapies. Tissue Eng 7: 211-228, 2001.
3. Dragoo JL, Samimi B, Zhu M, et al. Tissue-engineered
cartilage and bone using stem cells from human infrapatellar
fat pads. J Bone Joint Surg Br 85: 740-747, 2003.
4. Cowan CM, Shi YY, Aalami OO, et al.: Adipose-derived
adult stromal cells heal critical-size mouse calvarial
defects. Nat Biotechnol 22: 560-567, 2004.
5. Erickson GR, Gimble JM, Franklin DM, et al.: Chondrogenic
potential of adipose tissue-derived stromal cells
in vitro and in vivo. Biochem Biophys Res Commun 290:
763-769, 2002.
6. Mizuno H, Zuk PA, Zhu M, et al.: Myogenic differentiation
by human processed lipoaspirate cells. Plast Reconstr
Surg 109: 199-209, 2002.
7. Rodriguez AM, Pisani D, Dechesne CA, et al.: Transplantation
of a multipotent cell population from human adipose
tissue induces dystrophin expression in the immunocompetent
mdx mouse. J Exp Med 201: 1397-1405, 2005.
8. Planat-Benard V, Menard C, Andre M, et al.: Spontaneous
cardiomyocyte differentiation from adipose tissue
stroma cells. Circ Res 94: 223-229, 2004.
9. Safford KM, Hicok KC, Safford SD, et al.: Neurogenic
differentiation of murine and human adipose-derived
stromal cells. Biochem Biophys Res Commun 294: 371-379,
2002.
10. Planat-Benard V, Silvestre JS, Cousin B, et al.:
Plasticity of human adipose lineage cells toward endothelial
cells: physiological and therapeutic perspectives.
Circulation 109: 656-663, 2004.
11. Miranville A, Heeschen C, Sengenes C, et al.:
Improvement of postnatal neovascularization by human
adipose tissue-derived stem cells. Circulation 110:
349-355, 2004.
12. Yoshimura, K., Shigeura, T., Matsumoto, D., et
al.: Characterization of Freshly Isolated and Cultured
Cells Derived from the Fatty and Fluid Portions of
Liposuction Aspirates. J Cell Physiol, in press.
13. Cao Y, Sun Z, Liao L, et al.: Human adipose tissue-derived
stem cells differentiate into endothelial cells in
vitro and improve postnatal neovascularization in
vivo. Biochem Biophys Res Commun 332: 370-379, 2005.
14. Considine RV, Nyce MR, Morales LM, et al.: Paracrine
stimulation of preadipocyte-enriched cell cultures
by mature adipocytes. Am J Physiol 270: E895-899,
1996.
15. Rehman J, Traktuev D, Li J, et al.: Secretion
of angiogenic and antiapoptotic factors by human adipose
stromal cells. Circulation 109, 1292-1298, 2004.
16. Department of health and human services, Food
and Drug Administration: 21 CFR Parts 16, 1271 [Docket
No. 1997N?484P] Current Good Tissue Practice for Human
Cell, Tissue, and Cellular and Tissue-Based Product
Establishments; Inspection and Enforcement. Federal
Register, 69(226): 68612-68688, 2004.
|

