| 帀朾姴嵶朎壛帀朾堏怉弍乮Cell-Assisted
Lipotransfer乯偵傛傞朙嫻弍
媑懞峗懢榊丄徏杮戝曘丄嵅摗崕擇榊
|
侾丏偼偠傔偵
帀朾拲擖堏怉朄偼梀棧堏怉偱偁傞偨傔惗拝傗妋幚惈偵栤戣偑偁傞偲偝傟偰偒偨偑丄嵦庢晹傗堏怉晹偵釐嵀傪巆偝偢丄帺壠慻怐偱堎暔偵敽偆屻堚徢偑側偄丄旂曎堏怉偵斾傋偰宍懺宍惉偺帺桼搙偑崅偄丄怤廝偑彫偝偄庤弍偱偁傞丄側偳偺棙揰偑偁傝丄偲偔偵旤梕揑娤揰偐傜偼桪傟偨帯椕朄偱偁傝丄嬤擭巤峴悢偑媫懍偵憹壛偟偰偄傞丅偟偐偟丄帀朾堏怉偑書偊傞栤戣揰偼堏怉屻偺帀朾夡巰偵桼棃偟偰偍傝丄媄弍揑梫場偑帯椕寢壥偵戝偒偔塭嬁偡傞偨傔丄埨掕偟偨寢壥偑摼傜傟傞傛偆側帯椕朄偺夵椙傗昗弨壔偑昁梫偱偁傞丅
嬤擭丄帀朾慻怐偺慜嬱嵶朎乮娫幙寣娗嵶朎stromal-vascular cell丄帀朾娫幙嵶朎adipose stromal
cell)偵偼懡暘壔擻傪帩偮嵶朎偑娷傑傟偰偄傞偙偲偑巜揈偝傟[1]丄帀朾桼棃姴嵶朎乮adipose-derived
stem cell: 埲壓ASC乯偲傕屇偽傟傞傛偆偵側偭偨[2]丅帀朾慻怐偼戝検偵(亜侾L)嵦庢偡傞偙偲偑壜擻偱偁傞偨傔丄崪悜偵戙傢傞怴偨側惉恖姴嵶朎尮偲偟偰拲栚偝傟偰偄傞丅変乆偼偙偺ASC傪曗彆揑偵棙梡偟偰丄廬棃偺帀朾堏怉朄傪夵椙偟偨怴偟偄帯椕朄乮Cell-assisted
lipotransfer: CAL乯傪峫埬偟偨[3]丅杮峞偱偼丄杮帯椕朄偺婎杮奣擮丄弶婜椪彴尋媶偺寢壥傪曬崘偡傞丅
俀丏 媧堷帀朾桼棃嵶朎孮偲偼
帀朾媧堷偱嵦庢偝傟傞媧堷暔偼丄媧堷時偺拞偱擇憌偵暘棧偝傟傞丅忋憌偼丄晜梀偡傞媧堷帀朾偐傜惉傝丄壓憌偼媧堷攑塼偱偁傞丅偙偺媧堷攑塼偼丄Tumescent塼乮惗棟怘墫悈丄儕僪僇僀儞丄傾僪儗僫儕儞側偳乯丄枛徑寣丄慻怐攋嵱彫曅側偳偐傜側傞丅偙偺忋憌乮媧堷帀朾乯丄偍傛傃壓憌乮媧堷攑塼乯偺憃曽偐傜峺慺張棟偵傛傝娫幙寣娗嵶朎孮(stromal
vascular fraction丂[SVF]: 惉弉帀朾嵶朎偼彍偐傟偰偄傞乯傪嵦庢偡傞偙偲偑偱偒傞(恾侾)[4]丅偙偺嵶朎孮偼丄寣塼桼棃嵶朎乮敀寣媴側偳乯偑敿悢掱搙傪愯傔丄巆傝偼ASC傪偼偠傔丄寣娗撪旂嵶朎丄寣娗暯妸嬝嵶朎側偳帀朾慻怐桼棃嵶朎偱偁傞丅FACS偱暘愅偟偨SVF偺嵶朎峔惉傪昞侾偵帵偡(寣塼桼棃惉暘=CD45梲惈嵶朎偼徣偄偰偁傞)丅ASC偼娫梩宯姴嵶朎(MSC)傗旂晢桼棃慄堐夎嵶朎(DF)偲宍懺揑偵偼崜帡偟偰偄傞偑丄嵶朎昞柺峈尨敪尰偱偺堦斣戝偒側堘偄偼攟梴ASC偱偼CD34丄CD105偺敪尰偑尒傜傟傞偙偲偱偁傞(恾俀)[4]丅ASC偼懱撪偱寣娗撪旂嵶朎偵暘壔偡傞偙偲傕柧傜偐偲側傝丄惗棟揑偵偼帀朾偲寣娗丄憃曽偺慜嬱嵶朎偱偁傞偲峫偊巒傔傜傟偰偄傞[5]丅
俁丏 媧堷帀朾偲偼
媧堷帀朾慻怐偼嵶偄嬥懏僇僯儏乕儗偱媧堷偝傟傞偨傔丄戝偒側寣娗丒恄宱傗嵶朎奜婎幙偑惓忢帀朾慻怐偵斾傋偰彮側偄(恾俁)[3]丅媧堷帀朾偐傜ASC傪嵦庢偡傞偲丄惓忢帀朾慻怐偐傜嵦庢偟偨応崌偺敿暘掱搙(56亇12亾,
n=4)偺悢偟偐夞廂偱偒側偄乮慻怐妛揑偵傕CD34梲惈ASC偼寣娗暯妸嬝偺廃埻偵崅枾搙偵懚嵼偡傞偙偲傪妋擣偟偨乯丅媧堷帀朾慻怐偵ASC偑彮側偄偙偲偼丄忋婰偺戝寣娗偑朢偟偄偙偲偵壛偊丄婡夿揑側攋嵱傗撪場惈偺峺慺斀墳側偳偵傛傝丄媧堷庤弍拞傗媧堷時撪偱偺曐懚拞偵ASC偑攑塼拞偵梀棧偝傟偰偄傞壜擻惈傕偁傞丅媧堷帀朾偐傜ASC偑梀棧偝傟傞偙偲偼丄媧堷攑塼偐傜傕ASC偑扨棧偝傟傞[4]偙偲偐傜傕柧傜偐偱偁傞丅慻怐撪偵慜嬱嵶朎偑晄懌偟偰偄傞偙偲偑丄帀朾拲擖堏怉偵偍偄偰偺掅惗拝棪傗堏怉屻偺帀朾堔弅偺堦場偵側偭偰偄傞偲巚傢傟傞丅媧堷帀朾傪墦怱張棟(乣1200g)偡傞偲丄媧堷帀朾撪偺堦晹偺帀朾嵶朎偑攋夡偝傟傞偑ASC偼攋夡偝傟側偄偨傔丄慻怐撪偺ASC/adipocyte斾傪夵慞偡傞偙偲偑偱偒傞(1200g偺墦怱偱栺14亾)9乮恾係乯[6]丅
係丏 帀朾堏怉偺尰忬偲栤戣揰
帀朾堏怉偺棙揰偼丄嘆嵦庢晹偵傕堏怉晹偵傕釐嵀傪巆偝側偄丄嘇帺壠慻怐堏怉偱偁傞偨傔恖岺暔偵敽偆屻堚徢偑側偄丄嘊桳宻丒梀棧旂曎偵斾傋偰宍懺宍惉偺帺桼搙偑旕忢偵崅偄丄嘋挿婜揑偵帺慠側壛楊曄壔傪帵偡丄側偳偑偁偘傜傟傞丅堦曽丄寚揰偲偟偰丄嘆惗拝棪偑埆偄乮弍屻堏怉帀朾慻怐偑堔弅偡傞乯丄嘇媄弍揑梫場偵嵍塃偝傟寢壥偑晄埨掕偱偁傞丄嘊擷醰宍惉乮偟偙傝乯傗愇奃壔傪婲偙偡偙偲偑偁傞丄側偳偑巜揈偝傟偰偒偨丅尰嵼丄暷崙偱偼婄柺側偳偵懳偟偰擭娫栺6枩審巤峴偝傟偰偄傞偑丄擕朳偵懳偟偰偼傑偩彮側偄丅
擕朳傊偺帀朾堏怉偼80擭戙弶摢傛傝Bircoll傪偼偠傔嶶敪揑偵峴傢傟偨偑丄愇奃壔偑偱偒傞偙偲偑曬崘偝傟偨偨傔丄擕娻偺恌抐偺朩偘偵側傞壜擻惈偑偁傞偆偊偵旤梕揑側憹戝岠壥偑嵄嵶偱偁傞偲偟偰丄斲掕揑側堄尒偑1987擭偐傜嶨帍PRS偵偰暋悢偺儗僞乕偲偟偰宖嵹偝傟丄暷崙宍惉奜壢妛夛偺摿暿埾堳夛偼1989擭偵朙嫻栚揑偺帀朾堏怉傪旕擄偡傞僐儊儞僩傪敪昞偡傞偵帄偭偨[7,8]丅偦偺屻恖岺暔偵傛傞朙嫻弍偑昗弨偲偝傟傞偑丄恖岺暔偵傛傞崅昿搙偺僇僾僙儖峉弅乮愇奃壔傕乯丄儕僢僾儕儞僌側偳偺奜壢揑廋惓傪梫偡傞屻堚徢偑偁傞偨傔偵丄傑偨擕朳弅彫弍側偳懠偺擕朳宍惉弍偵偍偄偰傕愇奃壔偑昿夞偵擣傔傜傟傞偙偲偐傜丄擕朳傊偺帀朾堏怉傕堦晹偺宍惉丒旤梕奜壢堛偵偍偄偰峴傢傟偰偒偰偍傝丄媍榑偑懴偊側偄椞堟偱偁傞[8]丅嵦庢丒慜張棟丒堏怉媄弍偺夵椙偵傛傝丄帀朾堏怉弍偺偦偺巤峴悢偼憹壛偺堦搑傪偨偳偭偰偄傞乮10擭娫偱7攞偵憹壛丗暷崙ASPS摑寁乯丅偙偆偟偨帀朾堏怉偵娭傢傞媄弍偺恑曕丄傑偨擕偑傫偺恌抐憰抲丒媄弍偺恑曕偵傛傝丄嵟嬤偼擕朳偵懳偡傞帀朾堏怉傪尒捈偡摦偒偑尒傜傟[8-11]
丄崱屻偼崌暪徢傪尭傜偟桳岠惈傪崅傔傞偨傔偺帯椕僾儘僩僐乕儖偺嵟揔壔偑媍榑偝傟偰偄偔偲巚傢傟傞[11]丅
5丏 CAL偺奣擮偲慜椪彴尋媶
変乆偼媧堷帀朾偺慜嬱嵶朎晄懌(掅ASC/adipocyte斾)傪夝徚偡傞栚揑偱丄暿偵梡堄偟偨媧堷帀朾偐傜怴慛ASC(幚嵺偵偼SVF)傪嵦庢偟偰棙梡偡傞帯椕朄傪峫埬偟丄Cell-Assisted
Lipotransfer (CAL)偲柦柤偟偨[3,12]丅墦怱張棟偟偨媧堷帀朾傪惗偒偨scaffold偲偟偰棙梡偟丄怴慛ASC傪偦偺scaffold偵愙拝偝偣偰丄ASC/adipocyte斾傪夵慞偟偨ASC-rich偺忬懺偱堏怉嵽椏偲偡傞(恾俆)丅
CAL偺摦暔幚尡偵偍偄偰丄堏怉帀朾偼ASC傪壛偊偨偲偒偵桳堄偵戝偒偔丄摿偵廃曈晹偵偍偗傞怴惗寣娗偺堘偄偑擣傔傜傟丄拞怱晹偺夡巰斖埻偑彫偝偐偭偨丅傑偨丄儔儀儖偟偨ASC偼堏怉帀朾偺寢崌慻怐撪傗惉弉帀朾嵶朎偺娫偵嫴傑傟傞傛偆偵惗懚偟偰偍傝丄堦晹偺ASC偑寣娗撪旂嵶朎偵暘壔偟偰偄傞偙偲偑帵偝傟偨[3]丅
丂CAL偵偍偗傞ASC偺栶妱偼係偮峫偊傜傟傞丅侾偮偼丄ASC偑惉弉帀朾嵶朎偵暘壔偟丄堏怉帀朾偺帀朾嵶朎偺堦晹傪峔抸偡傞偙偲丅ASC偼廬棃偐傜帀朾慜嬱嵶朎偲屇徧偝傟丄惉弉帀朾嵶朎偲嫟攟梴偡傞偲帀朾嵶朎傊偺暘壔偑桿摫偝傟傞偙偲偑抦傜傟偰偍傝[13]丄堏怉屻媫惈婜偺墛徢傗愙拝堏怉帀朾偺巋寖偵傛傞帀朾嵶朎傊偺暘壔偼廫暘偵峫偊傜傟傞丅俀偮傔偼丄ASC偑寣娗撪旂嵶朎傊暘壔偟丄媫惈婜偺寣娗怴惗偵婑梌偡傞偙偲丅ASC偑寣娗撪旂嵶朎傊暘壔偱偒傞偙偲偼嵟嬤偺暋悢偺尋媶[3,5,14,15]偵偍偄偰妋擣偝傟偨丅俁偮傔偼丄堏怉捈屻偺掅巁慺乮慾寣乯忬懺偵傛傝寣娗怴惗桿摫場巕傪曻弌偡傞偙偲偵傛傝丄廃埻偐傜偺寣娗怴惗傪桿摫偟丄堏怉慻怐偺惗拝偵婑梌偡傞偙偲偱偁傞丅ASC偼掅巁慺忬懺偱VEGF傗HGF側偳偺寣娗怴惗嶌梡傪帩偮憹怋場巕傪暘斿偡傞偙偲偑抦傜傟偰偄傞[16]丅係偮傔偼丄枹暘壔側ASC偺忬懺偱堏怉帀朾撪偵懚嵼偟丄慻怐摿堎揑慜嬱嵶朎偲偟偰棃偨傞帀朾嵶朎偺僞乕儞僆乕僶乕偵旛偊傞丅惓忢帀朾慻怐偼僞乕儞僆乕僶乕偑抶偄乮1.5乣3擭乯慻怐偲偟偰抦傜傟偰偄傞偑[17]丄堏怉偝傟偨帀朾慻怐偼堦帪揑側嫊寣忬懺偵傛傝嫊寣-嵞娨棳忈奞傪庴偗傞偨傔丄堏怉屻偺憗偄抜奒偱慻怐偑僞乕儞僆乕僶乕偡傞偙偲偑梊憐偝傟傞丅偙偺堏怉憗婜偺僞乕儞僆乕僶乕偵偍偗傞慜嬱嵶朎乮ASC乯晄懌偑弍屻偺堏怉帀朾慻怐偺堔弅偵娭楢偟偰偄傞偲偡傟偽丄ASC傪壛偊傞偙偲偵傛傞堔弅梷惂偑婜懸偱偒傞丅偙偺堏怉帀朾偺堔弅傪梷偊傞岠壥偼暋悢偺摦暔幚尡[3,
10,18]偐傜帵嵈偝傟偨丅
俇丏 CAL偺幚嵺
CAL偼偁傜備傞擃晹慻怐憹戝傊偺揔墳偑壜擻偱偁傞丅旤梕栚揑偺朙嫻[12]傪偼偠傔丄擕朳偺愭揤惈敪堢晄慡丒曄宍丄擕娻弍屻偺擕朳寚懝丒曄宍丄楻搇嫻丄婄柺偺帀朾堔弅徢乮Parry-Romberg徢岓孮丄怺嵼惈僄儕僥儅僩乕僨僗丄嫮旂徢側偳乯丄傾儞僠僄僀僕儞僌栚揑偺婄柺傊偺帀朾堏怉丄僸僢僾儕僼僩丄偦偺懠娻傗奜彎屻偺屻揤惈娮墯曄宍側偳偱偁傞丅朙嫻偺応崌偼戝検偺帀朾傪昁梫偲偡傞偨傔40kg埲壓偺憠偣偨姵幰偵偼岦偐側偄丅
乻庤弍曽朄乼
侾乯帀朾媧堷丗嵦庢晹偼捠忢偼戝戁乮傑偨偼亄暊晹乯偱偁傞丅挻壒攇傗僷儚乕僪偼巊梡偣偢丄堦斒揑側帀朾媧堷乮500-700mmHg乯偵傛傝媧堷帀朾検偲偟偰1000-1500ml嵦庢偡傞丅媧堷僇僯儏乕儗偼2mm埲壓偺嵶偄傕偺偼堏怉嵽椏偺嵦庢偵偼晄岦偒偱丄撪宎3mm掱搙偑朷傑偟偄丅
俀乯 ASC嵦庢梡帀朾偺張棟丗傑偢巒傔偺敿暘偺媧堷帀朾傪嵶朎張棟幒乮CPC乯傊憲傝丄峺慺張棟傪宱偰帀朾晹暘偍傛傃攑塼晹暘傛傝SVF傪嵦庢偡傞[4]丅偙偺岺掱偵偼栺俉侽暘傪梫偡傞丅
俁乯 堏怉梡帀朾偺張棟丗屻敿偺帀朾偼堏怉嵽椏偲偟偰張棟偡傞丅700-1200G偺墦怱張棟偵傛傝丄桘暘丒悈暘丒寣塼惉暘傪壜擻側尷傝彍嫀偡傞偲偲傕偵丄堏怉帀朾偺懱愊傪僐儞僷僋僩偵偡傞丅堏怉検偁偨傝偺慻怐憹戝検偼張棟偵傛傝戝偒偔堎側傞[6]丅
係乯 帀朾拲擖丗張棟偝傟偨SVF傪墦怱帀朾偵壛偊偰潣漚屻丄愙拝偝偣丄捈偪偵拲擖偵堏傞丅幒壏偱曻抲偟偨傝丄婡夿揑側張棟傪峴偆偙偲偵傛傝帀朾嵶朎偼偳傫偳傫攋夡偝傟偰偄偔偺偱懍傗偐側堏怉偑廳梫偱偁傞[19]丅僗僋儕儏乕幃僨傿僗億僔儕儞僕傪巊梡偟偰偄傞偨傔傾僔僗僞儞僩偑昁梫偵側傞偑丄嬌旝検偢偮偺拲擖偑壜擻偱偁傞偲偲傕偵丄堦婥偵擖傟夁偓傞偙偲傕側偄丅擕朳偵揑妋偵憌乆偱拲擖偡傞偵偼丄挿偄拲幩恓偑廳梫偱丄150mm偺18G恓乮塻恓乯傪巊梡偟偰偄傞乮恾俇乯丅擕朳壓峚丄擕椫曈墢側偳偺4売強偐傜弍幰偑恓傪巋擖偟丄拲擖恓傪彮偟偢偮堷偒側偑傜丄傾僔僗僞儞僩偑僾儔儞僕儍乕傪夞偟偰嵶偄慄忬傕偟偔偼揰忬偵拲擖偟偰偄偔乮恾俈乯丅堏怉偼擕態埲奜偺偁傜備傞帀朾丄偍傛傃嬝慻怐偵懳偟偰峴偆丅擕態壓偺嬝憌側偳怺偄憌偐傜弴偵擖傟偰偄偒丄嵟屻偵旂壓偵拲擖偟偰巇忋偘傞丅弍幰偑憓擖妏搙傗怺偝傪彮偟偢偮曄偊偰偒傟偄偵拲擖偟偰偄偔丅捠忢偼擕朳曅懁偵200-300ml偺帀朾傪拲擖偡傞丅
俆乯 弍屻働傾丄宱夁丗徚撆傗敳巺偼晄梫偱偁傞丅僔儍儚乕偼梻擔偐傜丄擖梺偼1廡娫屻偐傜壜擻偱偁傞丅弍屻偼帠慜偵梡堄偟偨揔愗側僒僀僘偺僽儔僕儍乕偱婑偣偰忋偘傞忬懺傪2廡娫堐帩偝偣傞丅堏怉帀朾偼摉弶偺1儢寧偼晄埨掕側忬懺偵偁傞偺偱丄僶僗僩偺儅僢僒乕僕偼偱偒傟偽3儢寧嬛巭偡傞丅敿擭丄堦擭丄埲屻堦擭枅偵丄擕朳嶣塭丄MRI偱愇奃壔側偳堎忢偑側偄偐傪僠僃僢僋偡傞丅
俈丏椪彴寢壥
丂2003擭傛傝80椺乮2007擭6寧尰嵼乯偵CAL傪峴偭偨丅撪栿偼丄擕朳偑73椺乮僀儞僾儔儞僩偐傜偺擖傟懼偊傪娷傓朙嫻63椺丄擕朳嵞寶8椺丄楻搇嫻2椺乯丄婄柺13椺乮庒曉傝10椺丄婄柺曅懁堔弅徢1椺丄怺嵼惈僄儕僥儅僩乕僨僗偵傛傞帀朾堔弅徢2椺乯丄鋅晹1椺乮廳暋偁傝乯偱丄1椺傪彍偒偡傋偰彈惈偱偁傞丅姵幰偺暯嬒擭楊偼36嵨丄暯嬒BMI偼20偲憠偣偰偄傞姵幰偑懡偄孹岦偑尒傜傟偨丅暯嬒堏怉帀朾検偼曅懁271ml丄暯嬒庤弍帪娫偼4帪娫15暘偱偁偭偨丅嵟崅42儢寧偺宱夁娤嶡傪峴偭偨丅
弍屻偼擕朳偵旂壓弌寣偑尒傜傟侾乣俀廡娫偱徚戅偡傞丅偍傛偦俀儢寧偱堔弅偑廔傢傝埨掕偟丄偦傟埲崀偺懱愊曄壔偼應掕岆嵎偺斖埻撪偱偁偭偨丅寢壥偼旕墦怱帀朾傪梡偄偨傕偺傛傝丄墦怱帀朾傪梡偄偨傕偺偑椙偔丄SVF傪cell
suspension偲偟偰暿偵拲擖偡傞偺偱偼側偔丄cell pellet偲偟偰帀朾偵愙拝偝偣偰堏怉偟偨傕偺偑椙偄丅姵幰偺枮懌搙偼崅偔丄慻怐憹戝岠壥偼慡椺偵偍偄偰擣傔傜傟偨丅惗拝偡傞帀朾偼屄恖嵎偑偁傝丄懱愊偱100乣200ml丄堏怉検偺40乣70亾掱搙偱偁傞丅姵幰娫偺屄恖嵎傪傕偨傜偡梫場偼傑偩摿掕偱偒偰偄側偄丅偙傟傑偱憹戝懱愊偺掕検昡壙偑偱偒側偐偭偨偑丄嶐擭傛傝棫埵嶰師尦應掕憰抲傪梡偄偨宱帪揑掕検昡壙傪奐巒偟偨偺偱僨乕僞傪拁愊偟偰曬崘偟偨偄乮恾俉乯丅擕朳偼帺慠側宍懺偍傛傃廮傜偐偄慻怐傪帵偟丄擕朳僀儞僾儔儞僩朙嫻弍屻偵尒傜傟傞傛偆側擕朳偺曄宍傗峉弅偼尒傜傟側偐偭偨丅戙昞揑徢椺傪恾俋乣侾侽偵嫙棗偡傞丅
弍屻専嵏偵偍偄偰丄擕朳73椺拞偙傟傑偱偵丄MRI傕偟偔偼CT偵偰擣幆偱偒傞擷醰乮宎12mm埲壓乯偑4椺偵丄擕朳嶣塭忋偺旝彫愇奃壔乮1mm埲壓乯偑3椺偵擣傔傜傟偨偑丄旝彫愇奃壔偼擕娻偺愇奃壔偲偺娪暿偼梕堈側傕偺偱偁偭偨丅
丂
俉丏峫嶡
丂偙傟傑偱擣傔傜傟偰偄傞帀朾堏怉偺寚揰偼丄偡傋偰梀棧帀朾慻怐偺夡巰偵桼棃偡傞傕偺偱偁傞丅帀朾堏怉弍偺悢乆偺媄弍揑側夵椙傪捠偟偰丄撦揑僇僯儏乕儗偱媧堷偟偨帀朾傪愻忩偣偢偵墦怱偟丄懍傗偐偵丄嵶偐偔堏怉偡傞丄偙偲偑僐儞僙儞僒僗偵惉傝偮偮偁傞[20]丅摿偵堏怉拲擖媄弍偼弉楙傪梫偟丄巊梡偡傞僨僶僀僗傕寢壥傪戝偒偔嵍塃偡傞丅
偝傜偵帀朾姴嵶朎傪棙梡偡傞偙偲偵傛傝丄惗拝棪傪崅傔丄挿婜揑側堔弅偺梊杊偑壜擻偲側傟偽丄偦偺堄媊偼旕忢偵戝偒偄丅変乆偺椪彴尋媶偵偍偄偰丄CAL偺堦掕偺埨慡惈偲桳岠惈偑妋擣偝傟偨丅桳岠惈偺昡壙偵偮偄偰偼丄偝傜偵崱屻偺掕検揑昡壙丄僐儞僩儘乕儖僗僞僨傿丄偍傛傃挿婜揑宱夁娤嶡偵傛傞昡壙偑昁梫偱偁傞丅寚揰偺側偄帯椕朄偼懚嵼偟側偄尰忬偐傜丄憤崌揑偵敾抐偟丄帯椕栚揑偵墳偠偰帯椕朄傪慖戰偡傞偙偲傕昁梫偲巚傢傟傞丅
63椺拞2椺偵偍偄偰SVF傪帀朾偵愙拝偝偣偢丄捠忢帀朾堏怉偺屻偵惗棟怘墫悈偵暘嶶偟偨cell suspension乮60ml乯偲偟偰暿搑堏怉偟偨偑丄偆偪1椺偵偍偄偰擕朳慡懱丄偍傛傃嫻崪忋偵峀偑傞慄堐壔傪妋擣偟偨丅帀朾姴嵶朎偺栚揑奜傊偺暘壔傪旔偗傞偨傔偵傕scaffold乮堏怉帀朾乯偵愙拝偝偣傞偙偲偺廳梫惈偑帵嵈偝傟偨丅
俋丏偍傢傝偵
丂朙嫻弍偼暷崙偱偼偙偺15擭娫偱巤峴悢偑10攞偵憹壛偟丄2006擭偵偼擭娫32枩審傪挻偊嵟傕巤峴悢偺懡偄旤梕奜壢庤弍偲側偭偨丅堦曽偱偼丄旤梕奜壢帯椕偵偍偗傞屻堚徢偺敿悢埲忋乮挊幰偺巤愝乯偑恖岺暔偵傛傞屻堚徢偱偁傝丄擕朳僀儞僾儔儞僩偺屻堚徢偵傛傞敳嫀庤弍傕悢懡偔峴傢傟偰偄傞偺偑尰忬偱偁傞丅擕朳僀儞僾儔儞僩姵幰偵偍偄偰偼丄嬄夌埵偱偺晄帺慠側擕朳宍懺丄擕朳偺峝偝傗幙姶丄寬峃恌抐傗恌嶡帪偺傢偢傜傢偟偝丄彨棃偵懳偡傞晄埨側偳丄擔忢惗妶忋丄幚偼怺崗側僗僩儗僗傪姶偠偰偄傞姵幰傕懡偄丅帀朾堏怉帯椕傕屻堚徢傪夞旔偡傞偨傔偵偼帯椕媄弍偺夵慞偑晄壜寚偱偁傞偑丄寚揰偑夝徚偱偒傟偽丄帺壠慻怐偱偁傞棙揰傪廫暘偵惗偐偡偙偲偑偱偒傞丅崱屻偺帀朾堏怉朄偍傛傃偦偺夵椙朄偺妋棫偑懸偨傟傞丅
堦曽丄帀朾桼棃姴嵶朎偼丄帀朾慜嬱嵶朎偱偁傞偲偲傕偵寣娗慜嬱嵶朎偱偁傞偙偲偑帵嵈偝傟偰偄傞丅嵟嬤丄摦柆偺寣娗暻乮暯妸嬝偺偡偖奜懁乯偵寣娗怴惗偵娭傢傞姴嵶朎偺懚嵼偑曬崘偝傟偨偑[21]丄偙偺嵶朎偼ASC偲摨堦偺嵶朎偱偁傞偲巚傢傟傞丅峀斖埻偺椪彴暘栰偵偍偄偰墳梡壜擻側寣娗姴嵶朎偑媧堷帀朾偐傜嵦庢偱偒傞偲偡傟偽丄偦偺堛妛揑堄媊偼旕忢偵戝偒偄丅
嶲峫暥專
1) Zuk PA, Zhu M, Ashjian P, et al. Human
adipose tissue is a source of multipotent stem cells.
Mol Biol Cell 13: 4279-4295, 2002.
2) Gimble JM, Katz AJ, Bunnell BA. Adipose-derived stem
cells for regenerative medicine. Circ Res 100: 1249-1260,
2007.
3) Matsumoto D, Sato K, Gonda K, et al. Cell-assisted
lipotransfer: supportive use of human adipose-derived
cells for soft tissue augmentation with lipoinjection.
Tissue Eng 12: 3375-3382, 2006.
4) Yoshimura K, Shigeura T, Matsumoto D, et al. Characterization
of Freshly Isolated and Cultured Cells Derived from the
Fatty and Fluid Portions of Liposuction Aspirates. J Cell
Physiol 208: 64-76, 2006..
5) Planat-Benard V, Silvestre JS, Cousin B, et al. Plasticity
of human adipose lineage cells toward endothelial cells:
physiological and therapeutic perspectives. Circulation
109: 656-663, 2004.
6) Kurita M, Matsumoto D, Shigeura T, et al. Influences
of centrifugation on cells and tissues in liposuction
aspirates: optimized centrifugation for lipotransfer and
cell isolation. Plast Reconstr Surg, in press.
7) Shiffman MA. History of breast augmentation with fat.
In Autologous fat transplantation (edited by Shiffman
MA), Mercel Decker, Inc., New York, 2001, pp199-206.
8) Coleman SR, Saboeiro AP. Fat grafting to the breast
revisited: safety and efficacy. Plast Reconstr Surg 119:
775-785, 2007.
9) Spear SL, Wilson HB, Lockwood MD. Fat injection to
correct contour deformities in the reconstructed breast.
Plast Reconstr Surg 116:1300-1305, 2005.
10) Moseley TA, Zhu M, Hedrick MH. Adipose-derived stem
and progenitor cells as fillers in plastic and reconstructive
surgery. Plast Reconstr Surg 118(3 Suppl): 121S-128S,
2006.
11) Spear SL, Newman MK. Discussion to 乬Fat grafting to
the breast revisited: safety and efficacy乭, Plast Reconstr
Surg 119: 786-787, 2007.
12) Yoshimura K, Sato K, Aoi N, et al. Cell-Assisted Lipotransfer
(CAL) for Cosmetic Breast Augmentation -Supportive Use
of Adipose-derived Stem/Stromal Cells-. Aesthtic Plast
Surg, in press.
13) Considine RV, Nyce MR, Morales LM, et al. Paracrine
stimulation of preadipocyte-enriched cell cultures by
mature adipocytes. Am J Physiol 270: E895-899, 1996.
14) Miranville A, Heeschen C, Sengenes C, et al. Improvement
of postnatal neovascularization by human adipose tissue-derived
stem cells. Circulation 110: 349-355, 2004.
15) Cao Y, Sun Z, Liao L, et al. Human adipose tissue-derived
stem cells differentiate into endothelial cells in vitro
and improve postnatal neovascularization in vivo. Biochem
Biophys Res Commun 332: 370-379, 2005.
16) Rehman J, Traktuev D, Li J, et al. Secretion of angiogenic
and antiapoptotic factors by human adipose stromal cells.
Circulation 109, 1292-1298, 2004.
17) Strawford A, Antelo F, Christiansen M, et al. Adipose
tissue triglyceride turnover, de novo lipogenesis, and
cell proliferation in humans measured with 2H2O. Am J
Physiol Endocrinol Metab 286, E577-588, 2004.
18) Masuda T, Furue M, Matsuda T. Novel strategy for soft
tissue augmentation based on transplantation of fragmented
omentum and preadipocytes. Tissue Eng 10: 1672-1683, 2004.
19) Matsumoto D, Shigeura T, Sato K, et al. Influences
of preservation at various temperatures on liposuction
aspirates. Plast Reconstr Surg, in press.
20) Kaufman,MR, Miller TA, Huang C, et al. Autologous
Fat Transfer for Facial Recontouring: Is There Science
behind the Art? Plast Reconstr Surg 119: 2287-2296, 2007.
21) Zengin E, Chalajour F, Gehling UM, et al. Vascular
wall resident progenitor cells: a source for postnatal
vasculogenesis. Development 133, 1543-1551, 2006.
Legends

恾侾丏帀朾媧堷夞廂暔偐傜偺嵶朎偺嵦庢乮暥專係傛傝夵曄乯
帀朾媧堷撪梕偼丄忋憌偺晜梀暔偼攋嵱偝傟偨媧堷帀朾慻怐偱丄壓憌偺媧堷攑塼偼惗棟怘墫悈丄寣塼丄慻怐孄側偳偺崿崌暔偱偁傞丅忋憌丄壓憌偺憃曽偐傜帀朾慜嬱嵶朎乮帀朾桼棃姴嵶朎ASC乯傪娷傓娫幙寣娗嵶朎孮乮SVF乯傪嵦庢偡傞偙偲偑壜擻偱偁傞丅椪彴偱偼SVF傪攟梴偣偢偵巊梡偡傞丅
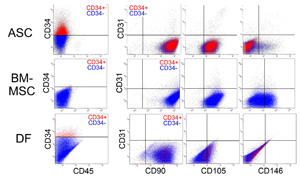
恾俀丏僸僩攟梴嵶朎偺儅儖僠僇儔乕僼儘乕僒僀僩儊僩儕乕夝愅(暥專係傛傝夵曄)
ASC(帀朾桼棃姴嵶朎乯丄BM-MSC(崪悜桼棃娫梩宯姴嵶朎乯丄偲DF(恀旂桼棃慄堐夎嵶朎)傪CD34丄CD45(寣塼嵶朎儅乕僇乕)丄CD31(寣娗撪旂儅乕僇乕)偲偝傜偵侾偮偺昞柺峈尨乮CD90丄CD105丄傑偨偼CD146乯偱暘愅偟偰偁傞丅宍懺揑偵偼偄偢傟傕慄堐夎嵶朎條偱偁傝嬤帡偟偰偄傞丅ASC偼MSC偲DF偵斾傋偰丄CD34偺敪尰偑尠挊偱偁傝丄ASC偲MSC偼CD105乮娫梩宯姴嵶朎偺儅乕僇乕偲偟偰傕巊傢傟傞乯傗CD146乮寣娗撪旂嵶朎丄廃嵶朎偺儅乕僇乕偲偟偰傕巊傢傟傞乯偺敪尰偑尒傜傟傞揰偑DF偲偼柧傜偐偵堎側偭偰偄傞丅
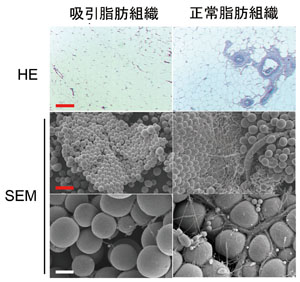
恾俁丏媧堷帀朾偲愗彍帀朾偺宍懺妛揑斾妑(暥專俁傛傝夵曄)
乮偲傕偵摨堦姵幰偺暊晹傛傝嵦庢偟偰斾妑丟忋偺抜偼僷儔僼傿儞昗杮偺HE愼怓丄拞抜丄壓抜偼憱嵏揹尠昗杮偺庛奼戝偲嫮奼戝乯丅婎杮峔憿偼偳偪傜傕傎傏摨條偱偁傞偑丄媧堷帀朾偵偼戝寣娗偑旕忢偵彮側偄丅媧堷帀朾偺応崌偼丄嵶偄僇僯儏乕儗偵傛傝戝寣娗傗恄宱傪彎偮偗側偄傛偆偵嵦庢偝傟偰偄傞偙偲偵傛傞偲巚傢傟傞丅Bar(愒)偼200兪m丄Bar(敀)偼40兪m丅
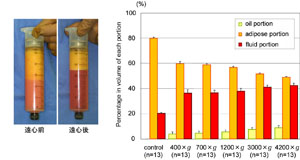
恾係丏媧堷帀朾偺墦怱張棟乮暥專俇傛傝夵曄乯
乮嵍乯墦怱張棟屻偼僆僀儖憌丄帀朾慻怐憌丄攑塼憌偵暘偐傟傞丅帀朾慻怐憌偼悈暘偑暘棧偝傟僐儞僷僋僩偵側傞丅
乮塃乯墦怱椡偺堘偄偵傛傞嶰憌偺懱愊偺曄壔丅僆僀儖憌偼帀朾嵶朎偺攋夡傪斀塮偡傞丅墦怱偵傛傝帀朾嵶朎偼堦晹攋夡偝傟傞偑丄ASC偼傎偲傫偳偑惗懚偟偰偄傞丅
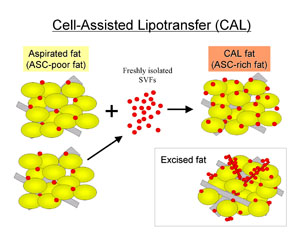
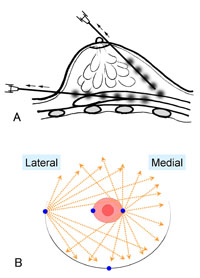
恾俆丏Cell-Assisted Lipotransfer (CAL)偺婎杮奣擮乮暥專12傛傝乯
媧堷帀朾偼愗彍帀朾偵斾偟丄娷傑傟偰偄傞ASC偺悢偑彮側偄丅ASC偑憡懳揑偵寚朢偟偰偄傞媧堷帀朾傪scaffold偲偟偰ASC傪壛偊偰愙拝偝偣傞偙偲偵傛傝丄ASC-rich帀朾偲偟偰堏怉嵽椏偲偡傞丅
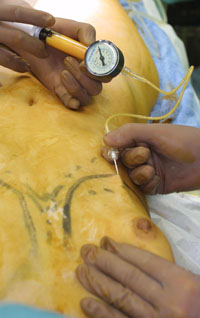
恾俇丏帀朾拲擖偺條巕乮暥專12傛傝乯
150mm偺18G恓傪梡偄傞丅弍幰偑拲擖恓傪攃帩偟偰彮偟偢偮堏摦偝偣傞丅傾僔僗僞儞僩偼僾儔儞僕儍乕傪夞偟偰丄帀朾傪拲擖偟偰偄偔丅帀朾傪揔愗偵堏怉偡傞偨傔偵偼僨僶僀僗偲拲擖朄偑惉斲傪嵍塃偡傞尞偲側傞丅
恾俈丏擕朳傊偺帀朾拲擖偺柾幃恾(暥專12傛傝)
拲擖偼恾偺傛偆偵4売強偐傜丄拲擖偡傞曽岦偲憌傪偢傜偟側偑傜丄嵶偐偔挌擩偵彫偝偄嬍偐嵶偄巺傪抲偄偰偔傞傛偆偵擖傟偰偄偔丅擕態傪旔偗偰丄旂壓帀朾丄擕態壓帀朾丄嫻嬝撪側偳偵丄怺偄憌偐傜弴斣偵帀朾傪愊傒忋偘傞傛偆偵堏怉偟偰偄偔丅
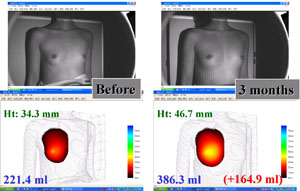
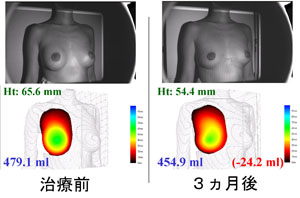
恾俉丏CAL朙嫻弍偵偍偗傞擕朳懱愊嶰師尦應掕憰抲偵傛傞應掕
丂23嵨丄彈惈丅俀俈侽倣倢偺CAL偵傛傞朙嫻弍傪峴側偭偨丅弍慜乮嵍乯偲弍屻3儢寧乮塃乯偺忬懺丅棫埵偵偍偄偰丄3揰偺婎弨揰偵傛傝掕媊偝傟傞昗弨暯柺傛傝庤慜偺懱愊傪應掕偡傞偙偲偑壜擻偱偁傞丅擕朳偺崅偝偼12.4mm憹壛偟丄擕朳偺懱愊偼164.9ml憹壛偟偰偄傞偙偲偑傢偐傞丅
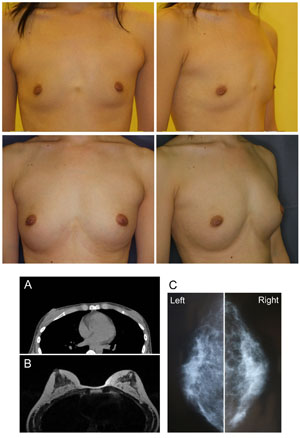
恾俋丏徢椺侾乮暥專12傛傝夵曄乯
30嵨丄彈惈丄寉搙偺嫻妔曄宍偑偁傞丅CAL偵傛傞朙嫻弍傪峴偄丄曅懁偵栺310ml傪堏怉偟偨丅
乮忋抜乯弍慜丄弍屻24儢寧偺忬懺丅
乮壓抜乯A: 弍慜偺CT丄B:弍屻24儢寧偺MRI丄C丗弍屻24儢寧偺擕朳嶣塭丅摿偵堎忢強尒傪擣傔側偄丅
恾侾侽丏徢椺俀
31嵨丄彈惈丄埲慜偵220ml偺僔儕僐儞僀儞僾儔儞僩傪憓擖偟丄僇僾僙儖峉弅傪婲偙偟偰偄傞丅朤擕椫愗奐傛傝僀儞僾儔儞僩傪敳嫀偟丄摨帪偵230ml偺CAL傪峴偭偨丅嶰師尦應掕憰抲偱弍慜丄弍屻偺昡壙傪峴偭偨偲偙傠丄弍屻3儢寧偵偍偄偰弍慜傛傝丄擕朳偺崅偝偼11.2mm丄懱愊偼24.2ml偲傕偵尭彮偟偰偄傞偑丄帺慠側擕朳偺宍懺偲幙姶傪幚尰偟偨丅乮僀儞僾儔儞僩偺懱愊傪峫椂偡傟偽195ml偺擕朳懱愊偺憹壛偑尒傜傟偰偄傞乯
昞侾丏媧堷帀朾偐傜嵦庢偝傟傞怴慛嵶朎孮(stromal vascular fraction)偺嵶朎峔惉 (暥專4傛傝夵曄)
媧堷帀朾偐傜嵦庢偝傟傞SVF偼丄帀朾桼棃嵶朎乮CD45-乯偲枛徑寣桼棃嵶朎乮CD45+乯偐傜惉傞丅帀朾桼棃嵶朎偺偆偪丄惉弉帀朾嵶朎偼張棟夁掱偱攋夡傕偟偔偼攑婞偝傟傞丅SVF偺拞偵娷傑傟傞帀朾桼棃嵶朎偼晄嬒堦側嵶朎廤抍偱偁傞偑丄偦偺戝敿偼ASC偱偁傞丅
丂 CD31 CD34 CD45 CD90 CD105 CD146 丂 峔惉斾
乮暯嬒亇昗弨岆嵎乯
ASCa 亅 亄 亅 亄 亅b 亅 71.0 亇 5.7%
寣娗撪旂嵶朎 亄 亄 亅 亄 亄 亄 7.3 亇 2.1%
寣娗廃嵶朎 亅 亅 亅 亄 亅 亄 3.8 亇 1.6%
寣娗廃慜嬱嵶朎c 亅 亄 亅 亄 亅 亄 0.5 亇 0.1%
慄堐夎嵶朎傎偐 亅 亅 亅 亄 亅 亅 丂 17.4 亇 4.9%
a: adipose-derived stem cell (帀朾桼棃姴嵶朎), b: 愙拝攟梴偡傞偲亄偲側傞,
c: 壖徧.

