| 1.はじめに
人工物の弊害が広く認識される中で、代替fillerとして自家脂肪の価値が再評価されている。長期的な臨床効果が明白に示されている以上、脂肪移植の有効性、有用性は技術的な進歩により高いレベルに到達するのであろう。移植部にも採取部にも瘢痕を残さない美容的には理想的特徴を持つ以上、その進歩がもたらす意義は大きい。一方で、脂肪は熟練者でも非常に扱いに苦労する脆く傷みやすい組織であり、脂肪移植後の脂肪壊死に伴う不確実性が技術的な進歩でどこまで克服できるのか、答えは出ていない。実験的な研究と臨床データの蓄積および科学的な評価には多くの時間と労力が必要である。
近年の自家脂肪注入移植法の進歩には、大きく分けて①術者が直接関与する移植手技や採取手技(移植や採取する層、採取部位など)などの手術手技の進歩、②使用するデバイスや薬品などハードが関係する進歩、がある。本稿では②の進歩について、治療概念、移植技術についての最近の知見を踏まえて解説する。
2.脂肪吸引法(脂肪採取法)
脂肪吸引法にも多くの方法があるが、脂肪注入材料を採取するための脂肪吸引法(採取法)となると、痩身のための脂肪吸引法とは異なった、その目的に特化された吸引方法を行うことが重要となる。
a) 吸引器
脂肪採取に用いる脂肪吸引器は、①カニューレで吸引ポンプによる持続的陰圧で吸引、②電動で前後に動くカニューレで吸引ポンプによる持続的陰圧で吸引(powered
liposuction)、③超音波(これもカニューレの先からのinternal法と、事前に皮膚の上からプローブを用いて超音波をかけるexternal法がある)で脂肪組織を処理後に持続的陰圧で吸引、④ストッパー付きの吸引用シリンジで吸引、などに分けられる。このうち、超音波を用いるものは脂肪細胞が機械的外力や熱により破壊もしくは死滅する傾向がみられるため、移植脂肪の採取には明らかに不向きである。
破砕する脂肪吸引とは別に、脂肪組織を細いシリンジなどで切り取ってくる方法もある[1]。この方法の優れた点は、吸引脂肪ではなく、切除脂肪を移植材料として利用できる点にある(組織の破砕や陰圧によるダメージが小さい)。吸引した脂肪や遠心処理をすると脂肪細胞が壊れることはよく知られており[2,
3, 4]、吸引脂肪と切除脂肪では生着率に差がある[3, 5, 6]。自動吸引器を使うよりもシリンジの方が優れているという意見[17]もあるが、文献的には相違ないという見解がほとんどである[7](下記吸引圧の項参照)。
b) カニューレの太さ
鋭針(18Gから14G )、鈍カニューレ(18G から5mm)まで様々な吸引カニューレが使用されているが[8,
9]、14Gから18Gまでなら鋭針でも鈍針でも大きな違いはないという意見[8]もあれば、鈍針が良いという意見[10,
11]、鋭針では組織の破壊が大きいとする実験結果[8]や吸引も注入も直径が大きいほど良いとする見解[12]もある。一般的には、吸引も注入もカニューレの太さは太いほど良いと考えられており[13]、使いやすさを考慮に入れると、3mm鈍カニューレもしくは14G針
というのが一般的な共通認識と言える[ 9, 13]。
c) 吸引圧
シリンジは-0.6気圧(-450mmHg)程度で、吸引器でも約-0.9気圧(-700mmHg)を超えなければ問題ないとされる[7,
9]。-1気圧では90%の細胞がダメージを受けているとする報告も見られる[14]。
3. 脂肪処理法
a) 分離法
水分(ツメセント液)、油分(破壊された脂肪細胞)や血液との分離方法には、単純フィルター法、陰圧フィルター法、遠心法、倒置分離法などがある。遠心法とフィルター(綿タオル)では生着に有意差がなかったとされるが[15]、ともに水分を除去することの意義は大きいと考えられる[2,
4, 11]。
吸引脂肪に対する遠心処理は水分、オイル、血球の3つを取り除き、移植材料を質的に改善することを目的としている。有効性がなかったとする報告[16,
17]や強い遠心力により脂肪細胞が破壊されるとする見解もみられるが、その弊害よりも有用性の方が高いとする肯定的な意見が大半をしめる。
遠心には514gよりも228g(3分)が良かった(ラットの脂肪組織)とする報告[1]も見られるが、ヒト吸引脂肪を使った我々の研究[4]では3000g(3分)という強い遠心をかけても予想よりもはるかに多い(60%超)脂肪細胞が保存されていた。1200g(3分)で遠心をかけた場合、12%の脂肪細胞が破壊され、吸引脂肪の体積は水分が除かれて30%減少していたが、脂肪幹細胞(脂肪前駆細胞、adipose-derived
stromal cell: ASC)の有意な死滅・減少は見られず、結果的にASCの単位体積当たりの濃度は43%増加した(図1)。
b) 洗浄法(血球の分離)
混入している血液については、あるよりはない方が良いというのが統一見解とされている[7, 13]。混入している血液はマクロファージが移植細胞を除去することを刺激するという見解[13]もあるが、現時点では科学的根拠に乏しい。
洗浄する方法には、フィルターにかけて洗浄、倒置分離で複数回洗浄(生理食塩水、またはリンゲル液)などが行われるが(図2)、洗浄行為による細胞へのダメージの程度は実験結果や見解が分かれている。洗浄により血球は除去されるが、脆弱な脂肪細胞が破壊されることが想定できるため、最終的な脂肪生着にどの程度の影響があるかはまだ定かではない。遠心だけでも不完全ではあるが、一定の血球除去効果は認められる[4]。
c) 閉鎖処理か開放処理か
移植脂肪組織の感染のリスクを考えれば、明らかに閉鎖系処理が優れている。脂肪移植における細菌感染の報告は極めて稀ではあるが、起これば悲惨な後遺症につながるものである。しかし、移植脂肪の洗浄、薬剤などの均一な混合、大きな組織の切断処理などは、開放系でなければ困難であるし、開放系では他の処理も自由度が高く有利な点があるのも事実である。クリーン度の高い開放系があれば理想的である。
4.脂肪保存法、保存時間
a) 採取した脂肪組織の保存液、保存方法
生理食塩水で洗浄、保存する場合に比べて、細胞培養液(電解質、アミノ酸が含まれている緩衝液:DMEM、KGMなど)[18]や細胞保存(洗浄)液(ハンクス液など)の方が組織の損傷が小さい可能性がある。また、血清やアルブミンが混入されている方がさらに組織、細胞の保護作用が期待できると思われる。脂肪吸引の廃液には生理食塩水以外に出血による血清、アルブミンが含まれているため、生理食塩水よりも保護作用が高い可能性はある。空気に触れると脂肪細胞は死滅しやすいので、シリンジなどで閉鎖された状態での保存が可能であればより望ましいと思われる。
b) 保存温度
常温保存と冷蔵(4度)保存を比較すると明らかに冷蔵保存の方が優れている。我々のヒト吸引脂肪を使った実験では、常温保存の場合、4時間を超えると明らかに脂肪細胞の損傷が認められ、冷蔵脂肪とは有意差が認められた[19](図3)。
凍結した脂肪でも-20度で短期間(最高1年まで)であれば移植して問題ないとする意見[13]もあるが、凍結解凍により多くの成熟脂肪細胞を失うため、望ましくないという見解が現時点では大勢である。
c) 保存時間
保存温度の影響はあるが、一般的に保存時間が長いほど、死滅脂肪細胞が増加し、オイル分も増えてくる。ASCを採取する目的であれば、24時間の冷蔵保存は全く問題がないが、脂肪移植を目的とする場合には冷蔵保存でも2時間を超えると有意に脂肪細胞の死滅が見られると考えた方が良い[19]。すなわち、保存時間は10分でも短い方が望ましいと思われる。
5. 脂肪注入移植法
a) 混合物、添加物
インシュリンは脂肪融解を防ぐ、前駆細胞を脂肪細胞に分化させる働きがあるとして移植脂肪への混合添加物として利用されることがあるが[20]、否定的な結果報告も見られる[3,
13]。その他には、ベータブロッカー[21]、IL-8[22]や細胞培養用培地[18]を加えることによる効果も報告されている。
我々はASCを補助的に利用した脂肪移植法(Cell-assisted lipotransfer: CAL)を開発し[23]、臨床応用を重ねてきた[24,
25]。吸引脂肪は切除脂肪に比べて生着が悪いと思われるが、その有力な原因の1つがASCの不足によるものと思われる。本法においては、遠心処理した吸引脂肪を生きたscaffoldとして利用し、新鮮ASCをそのscaffoldに接着させて、ASC/adipocyte比を改善したASC-richの状態で移植材料とする(図4)。ASCは成熟脂肪細胞に分化することができるだけでなく、血管内皮細胞へ分化できることも明らかにされている[23,
26, 27]。また、低酸素(阻血)状態により血管新生誘導因子を放出することも知られており[28]、移植後の低酸素状態で、脂肪新生、血管新生に寄与することが期待できる。正常脂肪組織はターンオーバーが遅い(1.5~3年)組織として知られているが[29]、移植された脂肪組織は一時的な虚血状態により虚血-再還流障害を受けるため、移植後の早い段階で組織がターンオーバーすることが予想される。この移植早期のターンオーバーにおける前駆細胞(ASC)不足が術後の移植脂肪組織の萎縮に関連しているとすれば、ASCを加えることによる萎縮抑制が期待できる[23,
30]。
b) シリンジ
術者が脂肪を的確に少量ずつ注入するためには、シリンジの大きさ(直径)が重要である。Colemanは顔面の場合は1ccのシリンジをそれ以外の部位では2.5mlのシリンジを推奨している。注入量が少ない部位ではやはり1mlのシリンジで的確な注入を行うことは結果を左右する決定的な要因の1つとなる。我々は、乳房、臀部などの大量脂肪注入の場合では、10mlや20mlのシリンジを使用しているが、少量ずつ注入するためにスクリュー式のディスポシリンジを使用している。アシスタントが必要になるが、極微量ずつの的確な注入が短時間で可能であるため、特に大量の脂肪注入を行う際には重宝する[24](図5)。
c) 注入針
注入針の太さはさまざまだが、14G から18Gまでのものが多く使われている(最も一般的に使用されているのは16G,
17G[10], 18G)。細いと長期的な予後が良くない[12, 31]とされ、18G までは良いが、20Gでは25-75%の細胞が損傷されているとされる[9,
32]。注入針の先端は鈍針が良いという意見が多い[10, 11, 13]が、その理由の1つは不必要な出血を避けることである。
我々は16Gか18Gの鋭針を用いている。その理由は、鈍針で行うと同じ注入腔に脂肪を移植することが多く、鋭針であれば瘢痕組織や線維の多い固い組織においても常に新しい注入腔を作りながら注入していくことが容易であるからである。
6. 今後の展開
脂肪組織、脂肪細胞についての研究は、この10年において飛躍的に進歩した。その理由は、①脂肪細胞が糖尿病、メタボリックシンドロームに密接に関連する内分泌器官としての機能が次々に明らかとなり、大きな研究対象となったこと、②脂肪組織特異的な前駆細胞である間質血管細胞が多能性の組織幹細胞として、また将来の細胞治療の有用なツールとして注目を浴びるようになったこと、である。そのため、広い範囲の生命科学研究者が脂肪組織、脂肪細胞を研究対象とするようになり、今後もこの傾向は続いていく。
これまで脂肪細胞の前駆細胞と考えられていた細胞は、血管にも分化することが明らかになった[19, 26,
27]。これまで血管の前駆細胞というのは血流によって供給されると考えられていたものが血管周囲に存在することが明らかになった[33]。脂肪組織は血流に乏しいと考えられていたが、実際は非常に血管(とくに毛細血管)の密度が筋肉よりも豊富な組織であることがわかった。脂肪細胞は多くの血管新生因子を分泌することが示された[28]。脂肪と血管には発生や新生においても互いに密接な相互作用があることが明らかになり、神経との関連も示唆されている。これまで脂肪組織の細胞の大半は脂肪細胞だと考えられていたが、実際には脂肪細胞は半数にも満たない可能性も出てきた。脂肪組織はターンオーバーしないという考えがあったが、実際には緩徐ではあるが1から4年でターンオーバーすることが示された[29]。肥満になるときは、脂肪細胞は肥大化するとともに、一定以上の大きさにはならず前駆細胞が積極的に分裂、増殖、および分化することも明確になった。
脂肪細胞、脂肪組織、前駆細胞についての知見が今後も急速に蓄積され続けることにより、形成外科治療においても新たな知見が随時反映されていくことが予想される。
7.おわりに
脂肪移植には確立されていない内容が非常に多い。その1つの理由は、移植技術により臨床結果が大きく異なること、であり、もう1つの理由は、ヒト脂肪移植の適切な実験モデルがないことである。飽食時代のヒトとラットでは、その脂肪組織は多くの点で異なっている。一方、ヒトの脂肪組織を免疫不全マウスに移植しても、移植床にはヒトの脂肪など軟部組織に相当する適切な移植可能な層が存在しない。このように、ある程度は臨床結果の蓄積に頼らざるを得ない、美容手術においてのコントロールスタディは難しく、一方で経験豊富な臨床家の主観的な意見だけではやはり科学的正当性には限界がある。
しかし、脂肪注入移植術は、瘢痕を残さず、異物による後遺症を伴わない、理想的ともいえる治療である。脂肪移植研究の障害にもかかわらず、特に近年は改めて見直す動き[11]とともに、以前にも増して多くの関心が寄せられており、これまでの臨床経験に基づくフィードバックに代わり、基礎研究のエビデンスに基づく新たな臨床研究が活発に行われていくことが期待されている。
文献
1. Guyuron B, Majzoub RK: Facial augmentation with
core fat graft: a preliminary report. Plast Reconstr
Surg 120: 295-302, 2007.
2. Pu LL, Cui X, Fink BF, et al.: The viability of
fatty tissues within adipose aspirates after conventional
liposuction: a comprehensive study. Ann Plast Surg
54: 288-292, 2005.
3. Nguyen A, Pasyk KA, Bouvier TN, et al.: Comparative
study of survival of autologous adipose tissue taken
and transplanated by different techniques. Plast Reconstr
Surg 85: 378-386, 1990.
4. Kurita M, Matsumoto D, Shigeura T, et al.; Influences
of centrifugation on cells and tissues in liposuction
aspirates: optimized centrifugation for lipotransfer
and cell isolation. Plast Reconstr Surg, in press.
5. Kononas TC, Bucky LP, Hurley C, et al.: The fate
of suctioned and surgically removed fat after reimplantation
for soft-tissue augmentation: A volumetric and histologic
study in the rabbit. Plast Reconstr Surg 91: 763-768,
1993.
6.Fagrell D, Enestrom S, Berggren A, et al.: Fat cylinder
transplantation: An experimental comparative study
of three different kinds of fat transplants. Plast
Reconstr Surg 98: 90-96, 1996.
7. Sommer B, Sattler G: Current concepts of fat graft
survival: histology of aspirated adipose tissue and
review of the literature. Dermatol Surg 26: 1159-1166,
2000.
8. Piasecki JH, Gutowski KA, Lahvis GP, et al.: An
experimental model for improving fat graft viability
and purity. Plast Reconstr Surg 119: 1571-83, 2007.
9. Shiffman MA, Mirrafati S: Fat transfer techniques:
the effect of harvest and transfer methods on adipocyte
viability and review of the literature. Dermatol Surg
27: 819-826, 2001.
10. Coleman SR: Structural fat grafting: more than
a permanent filler. Plast Reconstr Surg 118: 108S-120S,
2006.
11. Coleman SR, Saboeiro AP: Fat grafting to the breast
revisited: safety and efficacy.
Plast Reconstr Surg 119: 775-785, 2007.
12. Asken S: Autologous fat transplantation: Micro
and macro techniques. Am J Cosmetic Surg 4: 111-121,
1987.
13. Shiffman MA: Principles of autologous fat transplantation.
Autologous fat transplantation, edited by Shiffman
MA, pp5-22, Marcel Decker, Inc., New York, 2001.
14. Nguyen A, Pasyk KA, Bouvier TN, et al.: Comparative
study of survival of autologous adipose tissue taken
and transplanted by different techniques. Plast Reconstr
Surg 85: 378-386, 1990.
15. Ramon Y, Shoshani O, Peled IJ, et al.: Enhancing
the take of injected adipose tissue by a simple method
for concentrating fat cells. Plast Reconstr Surg 115:
197-201, 2005.
16. Brandow K, Newman J: Facial multilayered micro
lipo-augmentation. Int J Aesthetic Restor Surg 4:
95-110, 1996.
17. Fulton JE, Suarez M, Silverton K, Barnes T: Small
volume fat transfer. Dermatol Surg 24: 857-865, 1998.
18. Ullmann Y, Hyams M, Ramon Y, et al.: Enhancing
the survival of aspirated human fat injected into
nude mice. Plast Reconstr Surg 101: 1940-1944, 1998.
19. Matsumoto D, Shigeura T, Sato K, et al.; Influences
of preservation at various temperatures on liposuction
aspirates. Plast Reconstr Surg, in press.
20. Yuksel E, Weinfeld AB, Cleek R., et al.: Increased
free fat-graft survival with the long-term, local
delivery of insulin, insulin like growth factor-1,
and basic fibroblast growth factor by PLGA/PEG microspheres.
Plast Reconstr Surg 105: 1712-1720, 2000.
21. Ayhan M, Senen D, Adanalii B, et al.: Use of beta-blockers
for increasing survival of free fat grafts. Aesthetic
Plast Surg 25: 338-342, 2001.
22. Shoshani O, Livne E, Armoni M, et al.: The effect
of interleukin-8 on the viability of injected adipose
tissue in nude mice. Plast Reconstr Surg 115: 853-859,
2005.
23. Matsumoto D, Sato K, Gonda K, et al.: Cell-assisted
lipotransfer: supportive use of human adipose-derived
cells for soft tissue augmentation with lipoinjection.
Tissue Eng 12: 3375-3382, 2006.
24. Yoshimura K, Sato K, Aoi N, et al.: Cell-assisted
lipotransfer (CAL) for cosmetic breast augmentation
-supportive use of adipose-derived stem/stromal cells-.
Aesthetic Plast Surg, 2007 Sep 1; [Epub ahead of print].
25. Yoshimura K, Sato K, Aoi N, et al.: Cell-assisted
lipotransfer for facial lipoatrophy: efficacy of clinical
use of adipose-derived stem cells. Dermatol Surg,
in press.
26. Planat-Benard V, Silvestre JS, Cousin B, et al:
Plasticity of human adipose lineage cells toward endothelial
cells: physiological and therapeutic perspectives.
Circulation 109: 656-663, 2004.
27. Miranville A, Heeschen C, Sengenes C, et al.:
Improvement of postnatal neovascularization by human
adipose tissue-derived stem cells. Circulation 110:
349-355, 2004.
28. Rehman J, Traktuev D, Li J, et al.: Secretion
of angiogenic and antiapoptotic factors by human adipose
stromal cells. Circulation 109: 1292-1298, 2004.
29. Strawford A, Antelo F, Christiansen M, et al.:
Adipose tissue triglyceride turnover, de novo lipogenesis,
and cell proliferation in humans measured with 2H2O.
Am J Physiol Endocrinol Metab 286, E577-588, 2004.
30. Masuda T, Furue M, Matsuda T: Novel strategy for
soft tissue augmentation based on transplantation
of fragmented omentum and preadipocytes. Tissue Eng
10: 1672-1683, 2004.
31. Kononas TC, Bucky LP, Hurley C, et al.: The fate
of suctioned and surgically removed fat after reimplantation
for soft-tissue augmentation: A volumetric and histologic
study in the rabbit. Plast Reconstr Surg 91: 763-768,
1993.
32. Campbell GL, Laudenslager N, Newman J: The effect
of mechanical stress on adipocytes morphology and
metabolism. Am J Cosm Surg 4: 89-94, 1987.
33. Zengin E, Chalajour F, Gehling UM, et al.: Vascular
wall resident progenitor cells: a source for postnatal
vasculogenesis. Development 133: 1543-1551, 2006.
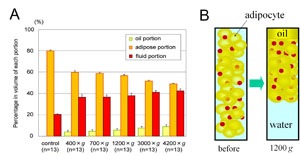
図1.吸引脂肪に対する遠心処理の影響(文献4より改変)
A. 遠心処理による各層の体積の変化: 遠心力が強くなるほど、脂肪層から水分が液層へと移動して、脂肪層の体積が減少し液層が増える。一方で、脂肪細胞の一部は破壊され、オイル層の体積が増えるが、強い遠心処理においても意外と脂肪組織は維持されることがわかる。
B. 1200×gの遠心処理による変化の模式図: 脂肪細胞の一部は破壊されてオイル層となるが、脂肪層から水分が除去されコンパクトになる。ASC(赤い小細胞で表してある)は破壊されず液層にも移動しないため、脂肪層における密度は高くなる。
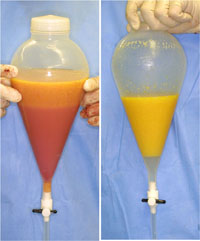
図2.吸引脂肪組織の洗浄の一例
洗浄法には様々な方法があるが、分液漏斗を使った一例を示す。洗浄を数回繰り返すことにより、血液成分がなくなり、鮮明な黄色の組織となる。しかし、保存液としては一時的に蛋白成分がなくなるので不利になるし、遠心をしないと水分は十分に除去されないことになる。
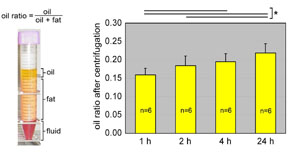
図3.吸引脂肪の常温保存による変化(文献19より改変)
吸引脂肪を常温で保存することにより、時間依存性にオイル層の体積が増える。時間とともに脂肪細胞が死滅し、4時間後には統計的有意差も認められた。
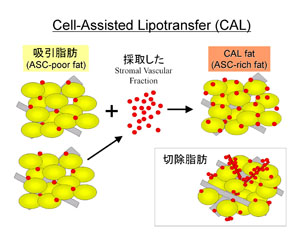
図4.脂肪由来前駆細胞を補助的に利用した脂肪移植法(Cell-assisted lipotransfer)の模式図
追加して採取した吸引脂肪からASCを含む間質血管細胞群(SVF)を採取して、移植用の吸引脂肪をscaffoldとして接着させて、新たな移植材料とする。切除脂肪では、血管周囲にASCが高濃度に存在する。
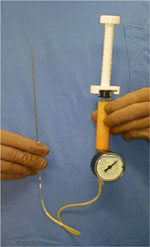
図5.スクリュー式脂肪注入用シリンジの一例
大量脂肪注入を行う場合には、不用意な大量注入を避ける意味で、スクリュー式微量注入器が有用である。この場合には150mmの18G鋭針とともに使用している。
|

