|
はじめに
毛乳頭細胞の毛包誘導能
毛乳頭の移植により毛包が誘導されることは、古くはラットなどの頬髭毛乳頭を用いた実験により明らかにされていた1,
7。例えばOliverらの実験7は毛包の下半分を切除して残った上半分の直下に毛乳頭を再移植して毛包が再生することを示したもので、これは現在の知識から言えば、バルジ領域の毛包幹細胞(上皮系幹細胞)が毛乳頭細胞の分化シグナルにより毛包へと分化する現象を見ていることに他ならない。その後さらに、Jahodaらは培養したラット毛乳頭細胞によっても毛包が形成されることを実証し、このときすでにヒト毛乳頭細胞の培養技術も確立していたこともあって、ヒト培養毛乳頭細胞を用いた毛包再生治療の実現を予見している3,
6。確かにヒト毛乳頭細胞を毛包誘導能を維持したまま培養することができれば、少数の毛包から毛乳頭細胞を採取して大量に培養し、禿髪部に自家移植することで毛髪再生治療がおこなえる可能性がある。しかし毛包誘導能は培養継代数を重ねると共に失われてしまうため、いかに毛包誘導能を維持したまま毛乳頭細胞を培養するかが課題となる。
これまでの毛髪再生の実験系
毛髪再生の実験系として、残念ながら確立されたin vitro assayはなく、今のところin vivo
assayに頼らざるを得ない。In vivo assay系はこれまでいくつか考案されており、単純な実験系としては、毛乳頭をマウスの皮内などに移植することで毛乳頭の生理活性をみる方法などがある8。またラット培養毛乳頭細胞を耳介皮膚の小切開に移植することで、移植部に通常より大きい毛包が誘導されることをみるという方法もある3。より洗練された方法として毛乳頭細胞と表皮細胞(または表皮)を組み合わせて移植する方法がある。Lichtら、Weinbergらはヌードマウスの背部にシリコン製のチャンバーを移植し、この中にラット毛乳頭細胞と表皮細胞をそれぞれ移植することで多数の毛包を誘導することに成功している5,
11。またInamatsuらはラット培養毛乳頭細胞を無毛皮膚であるラット足底皮膚表皮下に移植し、これをヌードマウス腎皮膜下や背部皮下に移植することで毛包を誘導している2。
ヒト毛乳頭細胞の毛包誘導能評価系確立にむけて
毛髪再生研究を効率的に進めるためには、培養した毛乳頭細胞の毛包誘導能を正しく評価できることが不可欠である。毛乳頭細胞の毛包誘導能の指標として特定の遺伝子発現や表面抗原などの簡便に測定できるbiomarkerは残念ながら現状存在しておらず、毛乳頭細胞をin
vivoで移植した後、毛包誘導を確認してはじめて(・・・・)その有無を評価することができる。われわれはこの現状を鑑み、さまざまな毛包再生の実験系を比較検討して、その中からヒト毛乳頭細胞の毛包誘導能評価系として最も優れた実験系を模索した。また将来的にはin
vitroで簡便できる測定法の確立を目指している。
チャンバーモデルとサンドイッチモデル
われわれは、比較対照とする実験系として、Weinbergらの方法11に準じた「チャンバーモデル」と、Inamatsuらの方法2に準じた「サンドイッチモデル」を選択した。「チャンバーモデル」は、ヌードマウスの背部にあらかじめシリコン製の「チャンバー」を移植しておく。チャンバーは筒状またはドーム状となっており、マウスは背部の皮膚に固定できるようになっている。10日前後でチャンバーによりポケットが形成されるので、そこに毛乳頭細胞と表皮角化細胞を懸濁液の状態で移植する。移植細胞として新鮮マウス胎児細胞を用いた場合では、移植後1ヶ月前後で発毛が確認できる(図1)。他方「サンドイッチ」とは、酵素によりラット足底皮膚を表皮と真皮に分離し、その間隙に培養毛乳頭細胞を挟み込むように移植することから、便宜上そのように呼んでいる(図2)。毛乳頭細胞を挟み込んだラット足底皮膚片は、さらにヌードマウス皮下に移植することでhostからの拒絶を回避する。再生毛包は、移植後3−4週間でラット皮膚片の表皮と真皮の間に形成される。皮膚片はマウス皮下にあるため体外への発毛は観察できないが、皮膚片を摘出することで毛乳頭・毛母・毛幹などの形成を観察することができる。
方法
毛乳頭細胞の培養
倫理委員会の承認のもと手術時に得た24例のヒト頭皮から毛包を採取し、毛乳頭部のみを実体顕微鏡下で摘出した(図3)。毛乳頭細胞の培養には、Inamatsuらの方法に準じて表皮角化細胞を培養して得られる培養上清を混合した培地を用いた2。ヒト皮膚から酵素処理により表皮角化細胞を採取し、Greenらの方法9に準じて、ヒト線維芽細胞をMitomycin
C(nacalai tesque)処理により得られたfeeder layerを用いて培養した。培養した表皮角化細胞はsub-confluentの状態から血清存在下で分化させ、このとき得られる培養上清を濾過により細胞成分などの不純物を除去後、-20℃で凍結保存しておいた。摘出した毛乳頭を培養皿の底面に貼り付け、保存しておいた表皮角化細胞培養上清50%およびヒト血清10%を添加したDMEM(GIBCO)にてexplant培養した。
チャンバーモデルの作成
内径5 mm、高さ15 mmの筒状シリコン製チャンバーを6週齢Balb/cヌードマウス背部に移植した(図1)。接着した培養毛乳頭細胞および培養表皮細胞を酵素処理により培地中に分散し、3×107個/mlの細胞懸濁液を調製した。チャンバー移植10日後に両者の細胞懸濁液を混合してチャンバー内に移植した。チャンバーは細胞移植後1週間で除去した。チャンバー除去後は背部皮膚に毛が生え出てくるか否かを観察した。毛の有無に拘わらず、細胞移植後6週間で移植部組織を一塊として摘出し、パラフィン包埋後8
μmピッチで薄切しHE染色に供した。
サンドイッチモデルの作成
毛乳頭細胞を継代培養し、confluentになり細胞外マトリックスを産生してシート状になった細胞を、cell
scraper(SUMILON)で剥がした後に細切して0.5 mm大の細胞塊にした。8週齢F344ラット足底皮膚から無毛部分を選んで5
mm四方で切り出し、ディスパーゼ(三共)処理によって表皮を基底層レベルで真皮から剥離した。毛乳頭細胞塊を剥離した表皮と真皮の間隙に注意深く挿み、足底皮膚片ごと6週齢Balb/cヌードマウス皮下に移植し、4週間後に摘出した(図2)。摘出した皮膚片はチャンバーモデルと同様に組織切片を作成した。
毛乳頭細胞ラベリング
再生毛包が移植細胞に由来していることを確認するために、毛乳頭細胞を細胞膜透過性蛍光色素であるCM-DiI(Molecular
Probe)によりラベリングした。移植前日に培地中に最終濃度5 μg/mlで添加し、37度24時間incubateした。ラベリングした毛乳頭細胞を前述のモデルに移植し、摘出した組織は凍結標本として8
μmピッチで薄切後、DAPI(VECTASHIELD, VECTOR)にて核染色し、蛍光顕微鏡(BioZero,
KEYENCE)で観察した。
結果
毛包誘導率
チャンバーモデルは13検体から培養した毛乳頭細胞を用いて26個を作成した。モデルを作成するのに必要な細胞を得るため、最大で5回継代する必要があった。体表に発毛を認めたものはなかったが、5個のチャンバーで組織学的に毛包様構造が確認された。サンドイッチモデルは、8検体から採取した毛乳頭細胞を最大3継代まで培養し、47個作成することができた。このうち24個に毛包が形成された(表1)。またチャンバーモデルはチャンバー装着部の感染やマウスが死亡するなどの理由で、標本を回収できずに評価不能だった個体が26個中10個存在したが、サンドイッチモデルでは評価不能のものは46個中6個のみであった。チャンバーモデルとサンドイッチモデルの、評価不能の検体を除いた1検体あたりの毛包誘導率はそれぞれ50.0±16.7%および52.1±10.0%であり、毛包誘導率に有意差は認められなかった。「ばらつき」の程度を表す変動係数(=標準偏差/平均)はそれぞれのモデルにおいて1.00および0.66であり、サンドイッチモデルの方が毛包誘導率の「ばらつき」が小さかった(表2)。
再生毛包の組織学的特徴
チャンバーモデルで誘導された再生毛包は、構造は不完全であるが、紡錘形をした毛乳頭と、未熟ながらも毛母、内毛根鞘の形成を認めた(図4)。ラベリング細胞を用いた移植実験では、CM-DiIにより標識された毛乳頭細胞を確認することはできなかった。また、ラベリング細胞の確認ができなかったことに加えて、細胞移植部とそれ以外の部分の境界が不明瞭で、ヌードマウス背部にもともと存在する毛包と再生毛包の区別が困難であった。サンドイッチモデルについては再生毛包の毛乳頭にCM-DiIにより標識された細胞が認められ、毛乳頭が移植したヒト細胞により再構成されていることが確認された(図5)。移植細胞は毛乳頭だけでなく毛包周囲の真皮毛根鞘や結合織内にも拡散して存在しており、その一部が毛乳頭として機能することがわかった。毛根鞘・毛母など上皮系細胞は標識されておらず、ラット由来細胞から分化したものであると考えられた。また、再生毛包はラット足底真皮マトリクスに囲まれるように形成されるため、ヌードマウスの毛包と容易に区別することができた。サンドイッチモデルでは、さまざまな分化段階の再生毛包が認められ、よく分化しているものでは毛乳頭・毛根鞘・毛母・毛幹を認め、複数の毛包が誘導されている場合もあった(図6)。
考察
チャンバーモデルとサンドイッチモデルの比較
比較した2つの実験系において毛包誘導率に有意差は認めなかった。しかしチャンバーモデルでは、マウスが死亡する、チャンバーが脱落する、感染するなどの理由で、最終的に回収できた個数は移植したモデル個数に対して61.5%であった。それに対してサンドイッチモデルは87.0%であった。これは、サンドイッチモデルはチャンバーモデルと比較してマウスに対する侵襲が小さいこと、またチャンバーモデルが外気に露出しているのに対して、サンドイッチモデルは標本が皮下に埋め込まれるため、感染や乾燥などの外的影響を受けにくいこと、などが原因として考えられた。
チャンバーモデルは、1つのモデルを作成するために少なくとも107個程度の培養細胞を準備する必要があるが、サンドイッチモデルでは5×105から106個程度の細胞数があればよい。そのためチャンバーモデルではサンドイッチモデルに比べて、細胞培養期間が長くなり、それだけ毛乳頭細胞のcharacterに不測の影響を与えかねず、実験条件がばらついてしまう恐れがある。このような細胞数の制限により、1度に作成できるモデルはチャンバーモデルがマウス1匹あたり1個であるのに対して、サンドイッチモデルは4−6個作成可能であった。すなわちサンドイッチモデルはチャンバーモデルよりも、同一条件のモデルを短期間で多数作成でき、再現性が高いと考えられた。
チャンバーモデルは、マウス胎児細胞を用いて作成した場合、体外への発毛を肉眼で観察できる、移植後長期間にわたりほぼ生理的な状態で観察を継続できる、などのメリットがある。しかしヒト細胞を用いた場合は体外への発毛は確認できず、組織学的に毛包を検索せざるを得ない。またヌードマウスの背部にはもともと細い産毛が存在するため、これらを再生毛包と組織学的に区別できない可能性がある。一方サンドイッチモデルでは、体外への発毛はあり得ないため必ず摘出して組織学的検索をおこなわなければならない。しかし再生毛包はマウス皮下に移植したラット足底皮膚(完全な無毛皮膚)の真皮と表皮の間に形成されるので、ここに毛包が誘導されればde
novo毛包であることが自明となる。すなわち、サンドイッチモデルはチャンバーモデルよりも既存毛包によるバイアスが少なく、false
positiveが少ないと考えられた。
またチャンバーモデルを作成するためには、毛乳頭細胞だけでなく表皮角化細胞を大量に培養する必要がある。培養により表皮角化細胞のviabilityや毛包への分化能が失われてしまう可能性があるので、表皮角化細胞が原因で毛包誘導が見られない可能性も存在する。一方サンドイッチモデルでは、表皮細胞のresourceはラットの足底皮膚であるため、常に安定した条件でモデルを作成することができる。したがってサンドイッチモデルはチャンバーモデルと比較して、表皮角化細胞に起因するfalse
negativeが少ないと考えられた。
CM-DiIによるラベリング細胞を用いた実験では、チャンバーモデルにおいては移植毛乳頭細胞の追跡はできなかったが、サンドイッチモデルでは良好にラベリングされており、移植細胞と再生毛包の解剖学的相関をよく分析することができた。チャンバーモデルでは移植期間が6週間に及ぶため、この間に蛍光色素が消退してしまうことが原因と考えられた。移植後の細胞の挙動を知ることは毛包誘導能を解析する上で重要であり、この点においてもサンドイッチモデルはチャンバーモデルよりも優れていると考えられた。
その他の実験系
毛乳頭細胞をマウスやウサギの皮膚においた小切開に移植すると、既存の毛包が大きくなる現象が観察される3,
8。この方法は簡便ではあるが、既存毛包の大きさは個体によって、あるいは部位によってばらつきが大きく、毛包誘導能の評価系としては再現性に乏しいと思われる。また単純に毛乳頭細胞をヌードマウスなどの皮膚に注射する方法もありえるが、この方法では現状としては毛包を再生することは困難であり、評価系として用いることができない。毛包を誘導するためには、毛乳頭細胞と表皮付近に存在する上皮系細胞とのinteractionが必要であり10、そのためには毛乳頭細胞を表皮基底層直下に注射しなければならないが、これは技術的に困難である。実際に毛乳頭細胞をマウスの皮膚に注射すると皮下組織に細胞が拡散してしまい、うまく毛包を誘導できない。現在当研究室では細胞を表皮基底層付近に的確に適量を注射できるデバイスを開発中である。
今回のサンドイッチモデルでは皮膚片としてラット足底皮膚を用いた。この場合の再生毛包はヒト由来毛乳頭細胞とラット由来表皮細胞から構成された、いわばキメラ毛包である。ヒト由来上皮系細胞に対する毛包誘導能を正確に反映するものではない。しかし、われわれはヒト皮膚を用いたサンドイッチモデルも試みたが、ヒト皮膚には被髪部以外でも産毛が多く存在するため毛包誘導能の正当な評価が困難であった。またヒト皮膚を安定して入手することは困難で、効率的に毛包誘導能を評価するモデルとしては実用的ではなかった。
今後の展開
今回の検討によりラット足底皮膚を用いたサンドイッチモデルは、他のモデルと比較して再現性が高く効率的なモデルであることがわかった。われわれは引続きこのサンドイッチモデルを用いて、毛乳頭細胞に様々な培養条件を与えて毛包再生実験をおこなっている。培養条件の変化は毛包誘導率に影響するだけではなく、毛包の大きさや成熟度など再生毛包の形態にも影響していることが判明しており、そこでさらに詳細な評価をすべく、サンドイッチモデルについて組織学的スコアリングシステムの確立を試みている。
また今回の実験において毛乳頭細胞は表皮角化細胞培養上清を用いて培養したが、われわれは表皮角化細胞培養上清にはFGF-1やFGF-2などを含めた様々な成長因子が豊富に含まれていることを別途確認しており、これらの因子が、単独で、または複合的に毛包誘導能の維持に寄与していると考えているが、その詳細は不明である。毛乳頭細胞の移植方法の最適化に加えて、毛包誘導能を維持しつつ毛乳頭細胞を大量に培養する方法の最適化も今後の大きな課題である。
まとめ
毛髪再生実験の代表的なモデルとして、チャンバーモデルとサンドイッチモデルがある。ヒト毛乳頭細胞の毛包誘導能評価系として両者を比較した。このうちラット足底皮膚を用いたサンドイッチモデルは再現性が高く効率的な評価系といえる。このモデルを用いて毛乳頭細胞の毛包誘導能を評価することで、将来の毛髪再生医療に向けて最適な毛乳頭細胞の培養条件が明らかにされていくと考えている。
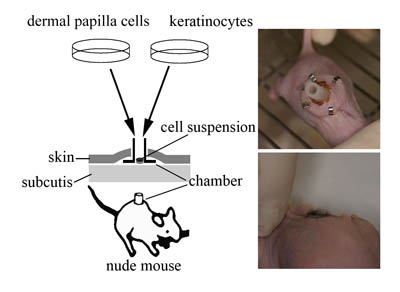
図1 チャンバーモデル
左:毛乳頭細胞(dermal papilla cells)と表皮角化細胞(keratinocytes)を培養し、両者をヌードマウスの背部に移植したシリコンチャンバー内に細胞懸濁液(cell
suspension)として混合移植する。右上段:ヌードマウス背部に移植されたシリコンチャンバー。右下段:マウス胎児細胞をチャンバーモデルに移植して再生した毛。
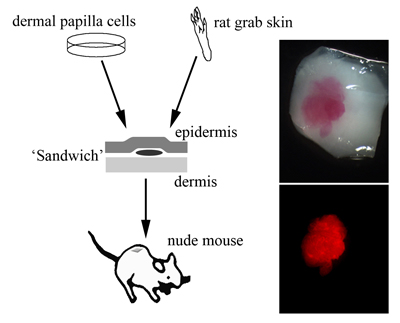
図2 サンドイッチモデル
左:毛乳頭細胞を培養し、ラット足底皮膚の表皮と真皮の間に挟む。これをさらにヌードマウスの皮下に移植する。右上段:移植直前のラット足底皮膚片。CM-DiIでラベリングされた毛乳頭細胞が透見できる。右下段:蛍光顕微鏡下で赤色の励起光を放つ毛乳頭細胞。
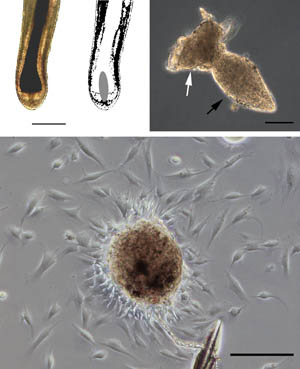
図3 毛乳頭の摘出とexplant培養
上段左・中:ヒト成長期毛包と毛乳頭の位置(灰色部)。bar = 500 μm。上段右:実体顕微鏡下で摘出された毛乳頭。毛乳頭(黒矢印)と線維性毛根鞘fibrous
sheath(白矢印)。bar = 100 μm。下段:explant培養開始後1週間前後で、貼り付けた毛乳頭を中心として毛乳頭細胞が放射状に遊走・増殖する。bar
= 100 μm。
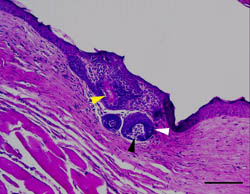
図4 チャンバーモデルで誘導された毛包
小さく不完全ではあるが紡錘形をした毛乳頭(黒矢印)と、未分化な毛母、内毛根鞘の形成を認めた(白矢印)。わずかに毛軸への角化を認める(黄矢印)。bar
= 500 μm。
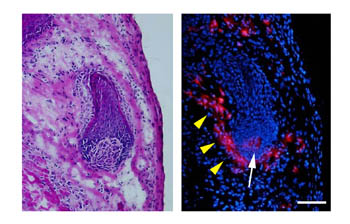
図5 再生毛包の毛乳頭を再構成する移植細胞
左:サンドイッチモデルで誘導された毛包(HE染色)。右:同じ毛包を蛍光顕微鏡下に観察するとCM-DiIにより標識された毛乳頭細胞が毛乳頭(白矢印)および線維性毛根鞘(黄矢印)に分布している。bar
= 100 μm。
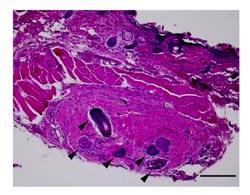
図6 サンドイッチモデルで誘導された再生毛包
ラット足底皮膚片の内部に複数の毛包が形成されている(矢印)。さまざまな大きさ、分化度の毛包を認める。画面上部の毛包はhostであるヌードマウスの背部皮膚の体毛。HE染色、bar
= 1 mm。
表1 チャンバーモデルおよびサンドイッチモデルにおける移植細胞の継代数、標本数、毛包誘導率
検体 継代数 移植個数(n) 回収個数(nc) 毛包誘導(ni) 毛包誘導率(ni/nc%)
チャンバーモデル OP-13 2 1 1 0 0
OS-03 2 1 1 1 100
IP-01 3 4 3 0 0
IP-02 3 4 4 0 0
OP-06 3 2 2 1 50
OP-09 3 1 1 1 100
OP-11 3 1 1 1 100
OS-01 3 3 0 ― ―
OS-04 3 2 0 ― ―
OP-03 4 2 0 ― ―
OS-01 4 2 1 1 100
OP-08 5 1 0 ― ―
OP-14 5 2 2 0 0
total 26 16 5 31.3
サンドイッチモデル KS-10 1 4 4 1 25
KS-11 1 4 4 3 75
KS-15 1 4 4 3 75
OS-04 1 5 2 1 50
OS-08 1 4 4 3 75
KS-10 2 4 4 4 100
KS-10 2 4 4 4 100
KS-11 2 4 0 ― ―
KS-12 2 4 4 2 50
KS-16 2 4 4 2 50
IP-03 3 4 4 1 25
OS-01 3 2 2 0 0
total 47 40 24 60
―;マウス死亡などの理由で標本を回収しなかった。
表2 チャンバーモデルおよびサンドイッチモデルにおける毛包誘導率と基本統計量
検体数 平均(%) 標準偏差(%) 標準誤差(%) 分散 変動係数
チャンバーモデル 9 50.0 50.0 16.7 2500 1.00
サンドイッチモデル 12 52.1 34.5 10.0 1188 0.66
|

