|
はじめに
脂肪の再生は、軟部組織の増大という、主に美容的治療効果を目的としている。軟部組織の増大術は、先天性・後天性陥凹変形の修正に加え、豊胸など純粋に美容的改善を目的として行われる治療法で、形成外科、美容外科領域では非常に需要の大きい治療の一つである。具体的には、癌切除後の陥凹変形、外傷後の陥凹変形、漏斗胸や片側顔面萎縮症(hemifacial
microsomia)などの先天性疾患、さらに純粋な美容目的では、豊胸術、隆鼻術、オトガイ増大術、頬・側頭部・上下眼瞼などの加齢性陥凹などへのニーズが高い。
軟部組織の増大目的には、遊離脂肪移植(脂肪注入術、真皮脂肪複合移植)、血管柄付き脂肪弁移植、血管柄付き筋皮弁移植、人工物の挿入術・注入術などが行われてきた。組織の増大が"注入治療"により実現できれば、瘢痕も残さず、形態改善の自由度も高い。人工物の注入剤では、古くはパラフィン、オルガノーゲン、シリコンジェルなどが使われたが異物反応をはじめ悲惨な後遺症を残す結果となった。現在、牛コラーゲン、ヒトリコンビナントヒアルロン酸、ポリ乳酸などが使われるが(我が国では牛コラーゲン以外は未認可)、いずれも吸収性材料であるため安全性は高いが、治療効果は一時的に過ぎない。一方、自家脂肪注入術はやはり古くから行われているが、移植脂肪は大半が壊死に陥り、治療効果が悪い上に、石灰化や線維化などの後遺症も見られ、決して満足できるものではなかった。近年、この脂肪注入法が見直され、様々な工夫により生着率が高くなった。我が国ではまだ認知度は低いが、今後再生医療技術を含めたさらなる移植技術の進歩が期待されている。自家脂肪注入の優れている点は、①自家組織であるためアレルギー、拒絶などの問題点がない、②移植材料の採取・移植行為ともに瘢痕を(ほとんど)残さない、③移植に際して形態修正の自由度が高い、④生着すれば軟部組織本来の柔らかさ、弾性、質感がある、⑤生着したものは残るので治療効果は一時的ではなく持続する、⑥異物反応としてのカプセル拘縮がない、などである。
脂肪の再生方法
これまでに再生医療技術を用いた脂肪の再生として、マトリゲル(Matrigel TM:Engelbreth-Holm-Swarm(EHS)マウス肉腫から採取された基底膜基質で、ラミニンを多く含む)とbFGFを混合して皮下に注入することによって脂肪新生が起こることが報告されており[1-4]、この実験系にヒト脂肪前駆細胞群を混入することによる効果の研究も行われている。この場合は移植床の周囲から幹細胞・前駆細胞がマトリゲルの中に遊走し、血管新生・成長に合わせて脂肪細胞へと分化して脂肪塊を形成すると考えられている。また、脂肪前駆細胞群をbFGFを混合してコラーゲンスポンジに播種したものを皮下に移植することによっても脂肪新生が報告されている。[5]一方、フィブリン糊をscaffordとして脂肪前駆細胞を播種し、in
vitroでの脂肪再生も試みられている。この場合は前駆細胞が増殖・分化し、周囲のマトリックスとともに脂肪塊を形成すると思われる。このように脂肪再生にはインテグリン受容体ファミリーを介した情報伝達ができるscaffordが現実的には必要であると思われる。
近年、脂肪組織内においても間葉系幹細胞とみなされるような未分化な多能性細胞が存在することが明らかになった[6-10]。この多能性細胞は、従来から脂肪前駆細胞、血管-間質系細胞、線維芽細胞様細胞などと呼ばれていた細胞の一部であるが、脂肪、軟骨、骨、骨格筋、心筋、腱などへ分化誘導できる可能性が示されている(図1)。脂肪組織内の間質から採取される細胞群には、間葉系幹細胞、脂肪前駆細胞、血管内皮(前駆)細胞、平滑筋細胞、周細胞などが含まれる。間葉系幹細胞を含む脂肪前駆細胞群は、成熟脂肪細胞間に接して存在しており、さらに脂肪組織内の結合組織内にも多数存在する。この細胞群は前述のごとくヘテロな集団であるがCD13、29、31(一部)、34、44、45(一部)、49d、54、58、71、73、90、105、106、117(一部)、146(一部)、151、SH3を発現しており、CD3、4、14、15、16、19、33、38、56、61、62e、62p、69、104、135、144が陰性である。分化誘導培地で培養すれば2-3週間で骨、軟骨、脂肪など臓器特異的な蛋白の発現が認められる。CD31、34、45、106、117などは培養期間が長くなると発現が無くなっていく。ヒト真皮由来培養線維芽細胞との違いは、線維芽細胞では多くの細胞でCD56が発現しているが、ヒト脂肪由来培養細胞群には見られない。逆に線維芽細胞ではCD105の発現が通常は見られない。一方、骨髄由来間葉系幹細胞ではCD49dの発現が通常は見られないという相違点がある。
この脂肪由来前駆細胞群を、脂肪吸引により採取された破砕脂肪と混合して移植すると、破砕脂肪の単独移植に比べて、血管新生が強く、移植脂肪も大きく成長することがSCIDマウスとヒト脂肪を使った実験で明らかとなっている(図 )。GFPラットを用いた脂肪組織と脂肪由来細胞群の混合移植研究では、移植後に脂肪由来前駆細胞群の局在が明らかになっている。現在この治療効果は臨床でも検証が行われている。脂肪は血管が豊富な組織であり、脂肪再生と血管新生は切っても切れない関係にあることはこれまでにも多くの研究で示唆されている。また、ラットでbFGF加デキストランビーズを破砕脂肪と混合注入することにより、生着率が高くなったことも報告されている
[11]。脂肪由来前駆細胞群は、さらに心筋梗塞、肝再生、血管新生への効果もin vivoの動物実験で示唆されており(personal
communication)、脂肪注入移植同様に臨床応用が検討されている。
実現にむけての課題
大きな脂肪を体外で作って移植し生着させることは、血行の問題が解決できないため現時点では不可能である。脂肪注入で移植される破砕脂肪組織は血行の問題はある程度解決できるが、それ自体は基本的に保存が効かない。すなわち、理想的には成熟脂肪組織に頼らずに、注入治療により脂肪再生を実現することが望ましい。このためには、①前駆細胞、②bioscafford、③増殖因子、のうち、どれか単独、もしくは複数を、外部から注入する治療で脂肪再生を実現させる必要がある。どこまで移植床のものが利用可能で、どこまでは体外より与えなければいけないのか、を検証する必要がある。前駆細胞としては脂肪組織由来前駆細胞に限らず、骨髄由来間葉系幹細胞、臍帯・胎盤由来間葉系幹細胞なども利用可能であると思われる。
残念ながらマトリゲルは臨床では使用できないため、それに変わりうる強力なbioscaffordが求められる。細胞外マトリックスが脂肪由来前駆細胞群の増殖、接着、遊走、脂肪分化において極めて重要なことも明らかになってきている[12、13]。細胞が足りないのであれば、保存可能である幹細胞・前駆細胞群であれば混合して使用することも想定される。また、脂肪組織が一定の体積を獲得するためには再生脂肪細胞内に脂肪が蓄積されていくプロセスが必要があり、そのためのインシュリンの役割も重要である。
おわりに
脂肪組織は採取されることによる機能障害が小さく、通常行われる脂肪吸引では吸引脂肪は日常的に廃棄されている組織である。すなわち、もともと脂肪吸引を希望している患者に関しては幹細胞採取に伴う倫理的な問題がない。脂肪組織由来前駆細胞群は血管新生、創傷治癒への治療効果も期待されており、さらに骨髄由来間葉系幹細胞に代わる、広い範囲の再生医療の細胞ソースとしての役割を演じる可能性も示唆されている。
参考文献
1. Kawaguchi N, Toriyama K, Nicodemou-Lena E, Inou
K, Torii S, Kitagawa Y. De novo adipogenesis in mice
at the site of injection of basement membrane and
basic fibroblast growth factor. Proc Natl Acad Sci
U S A. 1998, 95:1062-6.
2. Tabata Y, Miyao M, Inamoto T, Ishii T, Hirano Y,
Yamaoki Y, Ikada Y. De novo formation of adipose tissue
by controlled release of basic fibroblast growth factor.
Tissue Eng. 2000, 6:279-89.
3. Toriyama K, Kawaguchi N, Kitoh J, Tajima R, Inou
K, Kitagawa Y, Torii S. Endogenous adipocyte precursor
cells for regenerative soft-tissue engineering. Tissue
Eng. 2002, 8:157-65.
4. Kimura Y, Ozeki M, Inamoto T, Tabata Y. Time course
of de novo adipogenesis in matrigel by gelatin microspheres
incorporating basic fibroblast growth factor. Tissue
Eng. 2002, 8:603-13.
5. Kimura Y, Ozeki M, Inamoto T, Tabata Y. Adipose
tissue engineering based on human preadipocytes combined
with gelatin microspheres containing basic fibroblast
growth factor. Biomaterials. 2003, 24:2513-21.
6. Stashower M, et al: Stromal progenitor cells present
within liposuction and reduction abdominoplasty fat
for autologous transfer to aged skin. Dermatol Surg
25:945, 1999.
7. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz
AJ, Benhaim P, Lorenz HP, Hedrick MH: Multilineage
cells from human adipose tissue: implications for
cell-based therapies. Tissue Eng 7:211, 2001.
8. Zuk PA, Zhu M, Ashjian P, De Ugarte DA, Huang JI,
Mizuno H, Alfonso ZC, Fraser JK, Benhaim P, Hedrick
MH.: Human adipose tissue is a source of multipotent
stem cells. Mol Biol Cell 13:4279, 2002.
9. De Ugarte DA, Morizono K, Elbarbary A, Alfonso
Z, Zuk PA, Zhu M, Dragoo JL, Ashjian P, Thomas B,
Benhaim P, Chen I, Fraser J, Hedrick MH.: Comparison
of multi-lineage cells from human adipose tissue and
bone marrow. Cells Tissues Organs 174:101, 2003.
10. Dragoo JL, Choi JY, Lieberman JR, Huang J, Zuk
PA, Zhang J, Hedrick MH, Benhaim P.: Tissue-engineered
cartilage and bone using stem cells from human infrapatellar
fat pads. J Bone Joint Surg Br 85:740, 2003.
11. Eppley BL, Sidner RA, Platis JM, Sadove AM: Bioactivation
of free-fat transfers: a potential new approach to
improving graft survival. Plast Reconstr Surg 90:1022,
1992.
12. Patrick CW Jr, Wu X. Integrin-mediated preadipocyte
adhesion and migration on laminin-1. Ann Biomed Eng.
31: 505-14, 2003.
13. O'Connor KC, Song H, Rosenzweig N, Jansen DA.
Extracellular matrix su bstrata alter adipocyte yield
and lipogenesis in primary cultures of stromal-vascular
cells from human adipose. Biotechnology Letters 25:
1967-1972, 2003.
Legend
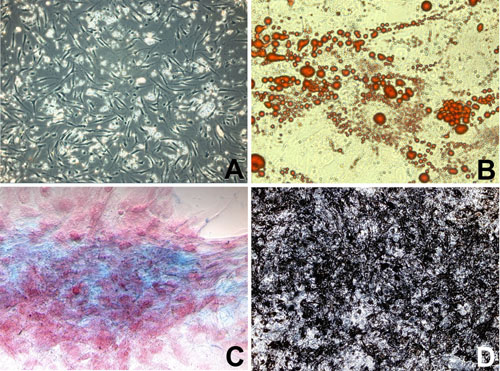
図1.吸引脂肪由来脂肪前駆細胞(間葉系幹細胞を含む)。A:細胞培養3日目の状態。B:脂肪分化誘導培地で培養後3週後の状態(オイルレッドO染色)。多くの細胞が脂肪滴を含んでいる。C:軟骨分化誘導培地で培養後3週間の状態(アルシアンブルー染色)、青色に染色されるムコ多糖類の分泌が認められる。D:骨分化誘導培地で培養後4週間の状態(フォンコッサ染色)。骨分化による石灰化が認められる。
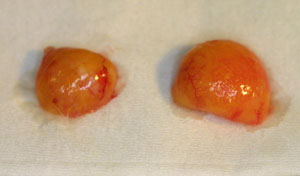
図2.ヒト吸引脂肪をSCIDマウスに移植し、4週間後の状態。左が脂肪前駆細胞を含まないもの、右は脂肪前駆細胞を混合移植したもの。
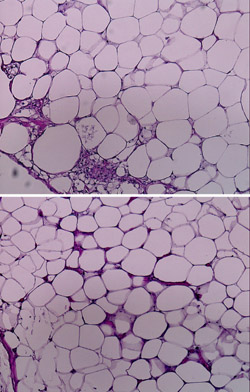
図3.ヒト吸引脂肪をSCIDマウスに移植し、4週間後の移植組織の周辺部の組織切片(HE染色、×100)。上が脂肪前駆細胞を含まないもの、下は脂肪前駆細胞を混合移植したもので新生血管が多く見られる。移植組織の中心部は、脂肪前駆細胞を含まない場合は大きな壊死組織となっている。
|

